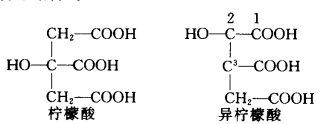柠檬酸
柠檬酸(Citric Acid)又名枸橼酸,学名为β-羟基丙三羧酸;2-羟基-1,2,3-丙三羧酸,有机化合物。化学式为C6H8O7(CH2COOH-C(OH)COOH-CH2COOH),摩尔质量为192.12g/mol。柠檬酸为无色透明或半透明晶体,或粒状、微粒状粉末,无味,具有强烈酸的味道,极易溶于水,易溶于乙醇,溶于乙醚,不溶于苯、甲苯、二硫化碳,其一水合物为轻微潮解的白色晶体,化学式为C6H8O7·H2O。柠檬酸属于一种中强酸,低于175℃会发生分解并生成多种物质,能与多种酸、碱反应,可以和甘油在不同条件下反应,生成的不同产物,如果以粉末或颗粒形式与空气混合,可能发生粉尘爆炸。柠檬酸主要由生物发酵法制备,也可以从水果中提取或者通过化学的方法合成,广泛应用于食品、金属净化、医药等领域。 基本信息
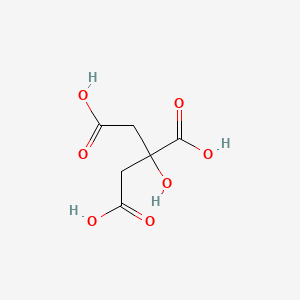
分子式
C6H8O7
CH2COOH-C(OH)COOH-CH2COOH
性质
危险性
相关历史
柠檬酸最早发现于1784年,由瑞典化学家Scheel首次从柠檬汁中提出柠檬酸并结晶出固体。1838年,由Liebig鉴定出柠檬酸是一种含有一个羟基的三元酸。1860年,意大利开始从果汁中用添加石灰乳的办法提取柠檬酸,从而进入工业化生产。 1891年,德国科学家Wehmer发现青霉菌有产生柠檬酸的能力,并陆续分离出很多产生柠檬酸的丝状真菌。1913年,Zahorski首先利用黑曲霉生产柠檬酸。1919年,比利时一家工厂成功地进行了浅盘发酵法生产柠檬酸。1923年,美国Pfizer公司开始采用黑曲霉浅盘发酵法工业化生产柠檬酸。此后,比利时、英国、德国、捷克、苏联等国家也相继研究成功并投入。1952年,Buelow和 Johnson等用15%蔗糖培养液发酵柠檬酸,发现通入无菌空气的量增加,柠檬酸发酵时间可缩短,这对柠檬酸发酵条件有了进一步的认识。1951年,美国Miles公司首先成功地采用深层发酵法工业化生产柠檬酸,比之前浅盘发酵法有更多的优越性。 分布
柠檬酸是生物体主要代谢产物之一,在自然界中分布很广,主要存在于柠檬、柑桔、菠萝、梅、李、梨、桃、无花果等水果中,尤其在未成熟者含量较多。植物叶子中(如烟叶、棉叶、菜豆叶等)也含有柠檬酸(常与苹果酸、草酸、酒石酸等共同存在)。在动物的骨骼、肌肉、血液、乳汁、唾液、汗液和尿液中,柠檬酸或以游离状态或以金属盐类的形式存在。 分子结构
异柠檬酸是柠檬酸的同分异构体,它的羟基在α位的C上,并且含有2个不对称C原子(2位C和3位C)。柠檬酸是一个叔醇不易氧化,而异柠檬酸则是仲醇容易氧化。异柠檬酸是三酸循环途径中的中间产物。用酵母菌发酵柠檬酸能产生大量的异柠檬酸,但通过诱变手段,可以选育出只生成极少量的异柠檬酸的突变株,已工业化生产。 理化性质
物理性质
柠檬酸为无色透明或半透明晶体,或粒状、微粒状粉末,无味,具有强烈酸的味道,极易溶于水,易溶于乙醇,溶于乙醚,不溶于苯、甲苯、二硫化碳。柠檬酸的摩尔质量为192.12g/mol,熔点为153℃,低于175℃会分解,闪点为100℃,自燃温度为1010℃,在空气中的爆炸极限为0.28%~2.29%(体积)。
一水合柠檬酸为轻微潮解的白色晶体,化学式为C6H8O7·H2O,摩尔质量为210.1g/mol。20℃在水中的溶解度为59.2g/100ml,密度为1.5g/cm,熔点为135℃,在175℃时会分解,自燃温度为1010℃。
化学性质
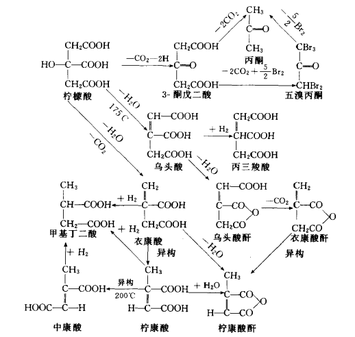
加热分解
柠檬酸加热可以分解成多种产物。下图为各种分解产物的关系与转化。
与酸反应
柠檬酸与发烟硫酸混合,在常温下反应生成乌头酸,稍微加热就能生成3-酮戊二酸。 柠檬酸与浓硫酸混合,温度在40℃时生成丙酮、二氧化碳和一氧化碳等;加热至150℃时生成乌头酸酐;加热至200℃时生成双康酸、一氧化碳和二氧化碳等。当硫酸浓度低于94%时,低温时生成3-酮戊二酸;当硫酸浓度低于60%时,加热时生成乌头酸。 无水柠檬酸与一份硝酸及二份硫酸反应生成硝酸酯C3H5(ONO2)(COOH)3,它不溶于醚,与钡及铅化合生成不溶性盐类。
与碱反应
与甘油反应
柠檬酸与甘油混合干馏得到丙酮、一氧化碳、二氧化碳和甘油内醚丙酮酸酯。
柠檬酸与甘油混合共热至100℃,生成柠檬酸甘油酯,这是一种玻璃状物质。如果甘油用量较多,加热至170℃时得到香茅二甘油(C12H16O11)。
柠檬酸与甘油按1比3的摩尔比共热,可以得到柠檬酸三甘油酯。用不同的摩尔比能获得不同性质树脂状物质,有的呈胶状或固体状,有的不溶于水,也有的溶于水。如果与桐油或油硬脂酸共热至100℃,可以缩合成树脂状物质,能作为油漆和塑料添加剂或特种溶剂。 其他反应
柠檬酸溶于氯化钠浓溶液中与氯反应生成六氯丙酮及氯仿。 100℃时,柠檬酸与高锰酸钾作用生成3-酮戊二酸和二氧化碳;在60℃时,生成甲醛和二氧化碳;在35℃以上时生成草酸。 高铁离子在日光下可使柠檬酸氧化为丙酮、水和二氧化碳。柠檬酸水溶液在日光下也能起分解作用。
柠檬酸氧化生成的3-酮戊二酸与溴作用能生成五溴丙酮沉淀,这是定性和定量柠檬酸的一种基本方法。 柠檬酸水溶液对碳钢的腐蚀较弱,对不锈钢不腐蚀,所以柠檬酸生产设备多用不锈钢材料制作。
柠檬酸加氢氧化钠中和后,加入氯化铁,加热会生成黄色沉淀,冷却后沉淀会溶解。 柠檬酸水溶液中加入数滴15%三氯化钛溶液,在常温下无反应,煮沸生成白色沉淀。
生理作用
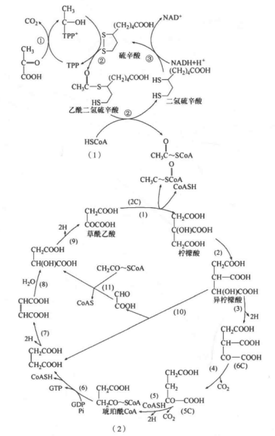
需氧生物在有氧条件下对糖的分解,并不只局限于糖酵解过程。糖酵解释放的能量极为有限,这对于多细胞的大型生物,是无法满足能量需求的。糖酵解过程仅仅是葡萄糖完全氧化的一个阶段,糖酵解产生的丙酮酸在有氧条件下不被还原成乳酸,而是进入线粒体继续进行有氧分解,通过柠檬酸循环彻底氧化最后分解成二氧化碳和水,并释放大量能量。这一过程被称为柠檬酸循环,因为在循环的一系列反应中,关键的化合物是柠檬酸,又因为它含有3个羧基,故又称三羧酸循环。为了纪念德国科学家Hans Krebs在阐明柠檬酸循环所做出的突出贡献,这一循环又称Krebs循环。柠檬酸循环途径的发现是生物化学领域的一项重大成就。1953年该项成就获得了诺贝尔生理学或医学奖。 制备方法
水果提取法
柠檬酸可以从柠檬、橙子、橘子等柠檬酸含量较高的水果中提取。在提取时,为了降低成本,常采用落地果、质量差的果、碎果、不能直接食用的次果,先进行榨汁、放置发酵、沉淀、加石灰乳,再取沉淀的柠檬酸石灰,然后用硫酸交换分解后精制而得。此法由于成本较高,未投入工业化生产。 化学合成法
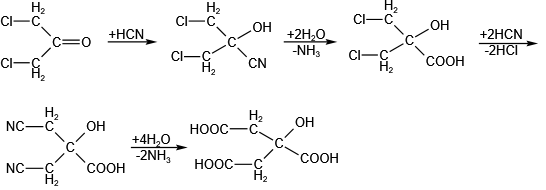
化学合成法的原料有丙酮、二氯丙酮或乙烯酮。以二氯丙酮为原料的合成路线如下: 生物发酵法
生物发酵法是制取柠檬酸的主要方法,它是以废糖蜜、淀粉、糖质等为原料,用黑曲霉菌发酵、沉淀,然后用石灰乳处理,获得的柠檬酸石灰用硫酸交换分解、精制而得。
应用领域
医药领域
柠檬酸与碳酸钠或碳酸氢钠水溶液共同反应产生大量二氧化碳和柠檬酸钠,可使药物中活性配料迅速溶解并增强味觉能力。例如:对泻药和止痛药有增溶作用。柠檬酸糖浆是发热病人用的清凉饮料,具有矫味、清凉、解毒的功效。 柠檬酸普遍应用于各种营养口服液等缓冲pH为3.5~4.5,维持活性配料的稳定性,加强防腐剂的效果。柠檬酸与水果香精合用,赋予人们喜爱的香酸口感以掩盖药物的苦味,尤其是中药制剂,在液态配料中加入0.02%柠檬酸可形成微量铁和铜的络合物,延缓活性配料的降解作用。在口嚼药片中采用0.1%~0.2%柠檬酸能改善药片的风味使其具有柠檬等的风味。
金属净化
以柠檬酸为基础的金属净化配方,能有效地去除黑色金属和有色金属表面形成的氧化物。作为一种弱有机酸,它可以使金属表面层轻微损害,然而作为金属离子鳌合剂则可加速金属氧化物的迁移,在许多钢材浸酸体系中,为了消除金属氧化物应力裂痕和使高强度钢材的侵蚀致脆减至最低程度,常采用柠檬酸除锈以代替无机强酸。 柠檬酸是高效鳌合清洗剂,对钙、镁、铁、铬、铜等污垢有效,广泛用于各种金属表面的清洗,洗后废水可生物降解,不污染环境。
食品领域
柠檬酸在食品工业的用量最大,约占总用量的70%,被称为第一食用酸味剂。在食品工业中可用作酸味剂、增溶剂、缓冲剂、抗氧化剂、除腥脱臭剂、整合剂等,广泛用于糖果、饮料、果酱、果冻、果酒以及罐头、糕点等食品的生产。柠檬酸的加入不仅可以赋予食品以水果风味,而且还具有抗氧化、保护色素和维生素的作用,使产品保持新鲜感。 其他
在化学工业中,柠檬酸的酯类可以制造无毒增塑剂,用于生产包装食品的塑料薄膜;在发电厂中常用柠檬酸溶液作为锅炉和管道的清洗剂;在建造水坝时,在混凝土中加入适量柠檬酸用作缓凝剂,提高工程的抗拉、抗压和抗冻性能。 安全标识
GHS分类
GHS | 危险说明 | 危险等级 |
H319 | 引起严重的眼睛刺激 | 严重的眼睛损伤/眼睛刺激 |
H335 | 可能引起呼吸道刺激 | 特异性靶器官毒性,单次暴露;呼吸道刺激 |
毒理学资料
小鼠经口LD50为5040~5790mg/kg,大鼠经口LD50为11700mg/kg,ADI不做任何规定。 健康相关
柠檬酸在体内为正常代谢产物。在人体中,柠檬酸为三羧酸循环的重要中间体,无蓄积作用。但多次内服大量含高度柠檬酸的饮料,会腐蚀牙齿琅质。血液内柠檬酸盐过多,与钙结合可引起低血钙症。
急救措施
食入:漱口,给予医疗护理。
皮肤接触:用大量水冲洗皮肤或淋浴,给予医疗护理。
眼睛接触:先用大量水冲洗几分钟,然后就医。
储存与运输
柠檬酸为非危险品,储存运输时注意容器密封,与强氧化剂、强碱、金属硝酸盐和金属分开存放。放置干燥通风处以防潮解。