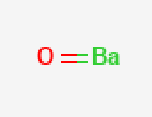氧化钡
氧化钡(barium oxide)是白色的钡的氧化物,也是一种无机化合物,化学式为BaO,呈白色至黄色粉末。其分子量为153.33,比重为5.72,熔点约1923 ℃,沸点约2000 ℃,密度为5.72 g/cm³,带有毒性。氧化钡溶于水、酸,易溶于碱金属的氯化物或硫酸盐的熔融液中,不溶于丙酮和氨。它具有强碱性及吸水性,极易从空气中吸收水分,并放出大量的热。氧化钡在空气中加热至500 ℃左右即被氧化成过氧化钡,600 ℃以上则又被还原成氧化钡,可通过强热碳酸钡与碳的混合物或直接将硝酸钡加热分解而得。氧化钡主要用于制造玻璃、钡盐和陶瓷,也用作脱水剂和气体干燥剂。 基本信息
性质
溶解性
溶于水、酸、易溶于碱金属的氯化物或硫酸盐的熔融液中,不溶于丙酮和氨
分布情况
钡的化学性质很活泼,它在空气中很快失去光泽,氧化成氧化钡。因此钡不会以纯净的形式出现在自然界中,而是与其他化学物质(如氧)结合形成可能作为矿物质发现的钡化合物。天然氧化钡的分布情况与钡分布情况有关。常见的钡矿有重晶石与毒重石。重晶石生成的地方包括:铅矿、锌矿、沉积岩、粘土矿床、海洋沉积层,以及某些火成岩。毒重石常见于低温液矿床。 晶体结构
氧化钡金属氧化物属于晶体中的离子晶体类型。离子晶体中的结点上是互相交替地排列着正离子和负离子,正负离子之间是以离子键的静电引力互相吸引着,这种力量较强,所以离子晶体都有较高的熔点和沸点,硬度较大,熔融后,正离子和负离子可以自由移动,有较强的导电性。 理化性质
物理性质
氧化钡是一种白色至黄色粉末,熔点约1923 ℃,沸点约2000 ℃,相对密度为5.72 g/cm³,溶于水、酸,易溶于碱金属的氯化物或硫酸盐的熔融液中,不溶于丙酮和氨。
化学性质
氧化钡具有强碱性及吸水性,有毒,极易从空气中吸收水份,形成具有腐蚀性的氢氧化钡溶液,并放出大量的热。
氧化钡与水作用生成氢氧化钡,氢氧化钡能进一步吸收二氧化碳而形成碳酸钡,其反应如下: 氧化钡在空气中加热至500℃左右即被氧化成过氧化钡。
制备方法
工业上制备氧化钡的制法是用碳使碳酸钡还原,或者在1000 ℃下使硝酸钡热分解。
①煅烧法:硝酸钡或碳酸钡在各种构造的坩埚炉中煅烧即得氧化钡。高纯度硝酸钡在通风条件下灼烧,以达到除去水分,再缓慢上升温度至1000~1100 ℃,使硝酸钡分解反应完全。 ②热解法:碳酸钡与碳共热(约1200 ℃)热解得到氧化钡,碳可以是焦炭、焦油和炭黑。先在950 ℃条件下使大部分二氧化碳分解放出,最后在1100~1200 ℃加热。 ③欲制备高纯氧化钡,则用精制的碳酸钡在高真空下进行热分解。
④过氧化钡在真空条件下进行热分解,也可制得高纯度氧化钡。将高纯度过氧化钡试剂进行干燥,然后在真空条件持续加热到400 ℃,待氧气停止大量外逸后加热到500~600 ℃,待真空条件满足后逐渐加热到900~950 ℃,最后在真空条件下冷却得到高纯度氧化钡。
应用领域
氧化钡主要用于制造玻璃、钡盐和陶瓷,也作用与精炼甜菜、气体干燥剂和阴极管材料等。
陶瓷
氧化钡是一种次生助熔剂,由于它具有结晶特性,所以能生成柔和的、丝绸般的亚光釉面效果以及多种鲜亮的颜色。氧化钡具有较高的黏稠度和适中的张力,所以它能起到增强釉料稳定性的作用,当氧化钡与其他助熔物质混合使用时可以产生极强的共熔性,进而会导致釉面流淌。大部分的氧化着色剂与氧化钡混合后都能生成鲜亮的颜色。
氧化钡是合成钛酸钡熔块的主要原料,也大量用作添加剂。氧化钡在电子陶瓷中既起助熔作用又起稳定剂作用,在锆酸盐陶瓷小能改善瓷料性能和降低烧结温度,在滑石瓷中既起助熔作用又能防止晶体老化。 玻璃
氧化钡能提高玻璃的物理和电性能。氧化钡能增加玻璃的折射率、密度、光泽和化学稳定性,少量的氧化钡(0.5%)能加速玻璃的熔化,但含量过多时,会与氧气发生反应生成过氧化钡。
含氧化钡玻璃吸收辐射线的能力较大,但对耐火材料侵蚀较严重。氧化钡常用于高级器皿玻璃、光学玻璃、防辐射玻璃等品种。瓶罐玻璃中也常加入0.5%~1.0%的BaO。作为助熔剂和澄清剂。 阴极管材料
低功率X射线管的阴极结构主要通过灯丝电流对氧化钡加热而发射电子。氧化钡具有较好的电子发射性能并且不易挥发造成靶面污染,因此能作为低功率X射线管的阴极结构。
干燥剂
氧化钡是非再生型的碱性干燥剂,主要用于实验室中中性或碱性气体、胺、醇的干燥,而不能用于酸性物质、醛、酮的干燥。氧化钡是非常有效的干燥剂,并且在赤热时是唯一能使用的干燥剂,但由于其价格昂贵和再生困难,因此不能广泛用于工业。
精炼甜菜
蔗糖可与氧化钡等金属氧化物发生置换反应。氧化钡能置换蔗糖分子中羟基的H形成加成化合物,工业上也称为蔗糖盐,此等加成化合物受酸的作用则分解出碱土金属盐,并游离出蔗糖,甜菜糖厂利用这种原理从糖蜜中以蔗糖盐形式提出蔗糖。 过氧化钡
氧化钡溶于水中,加入30%过氧化氢,在搅拌下加入氨水进行反应后,经洗涤、吸滤、110 ℃干燥、粉碎得到过氧化钡成品。 安全事宜
毒理数据
钡是一种竞争性钾通道拮抗剂,可阻断细胞内钾的被动外排,导致钾从细胞外区室转移到细胞内区室。细胞内钾的易位会导致静息膜电位降低,使肌纤维电不兴奋并导致麻痹。
健康危害
低剂量的钡剂能充当肌肉兴奋剂。高剂量的钡剂会影响神经系统,可能会导致呕吐、腹部绞痛、腹泻、呼吸困难、血压升高或降低、面部麻木和肌肉无力,严重时会导致死亡。钡剂还可能引起胃肠道紊乱,损害肾脏并导致体重下降。静脉注射钾通常可以缓解钡中毒的许多症状。 急救措施
不慎吸入该物质时,应当转移到空气新鲜的地方休息,并及时就医;皮肤接触时,脱掉被污染的衣物,用大量水冲洗皮肤或淋浴,若冲洗后仍有刺激,及时就医;眼睛不慎接触时,取下隐形眼镜(如果有佩戴),用大量水清洗几分钟,然后就医;误食时,用水漱口,并饮用大量水催吐(仅对清醒病人),然后转诊就医。
消防
氧化钡本身不会燃烧,但暴露在空气中会吸收空气中的水分,生成氢氧化钡并放出大量的热量,导致引起燃烧,燃烧后会释放有毒气体。常用的灭火剂有干粉、干沙、二氧化碳和泡沫等。根据不同的情况安排不同的灭火措施。当发生小面积火灾时可用二氧化碳(氰化物除外)、干粉、干沙、耐酒精泡沫灭火;当发生大面积火灾时可用水、雾或耐酒精泡沫灭火,并避免直接对准火源。 溢漏处理
氧化钡发生溢漏时,将溢漏物清扫进密闭容器中,小心收集残余物,然后转移到安全场所(注意个人防护,佩戴自吸式呼吸器)。
储存
储存在严格密封容器中,与食品、饲料和酸类分开储放,并保持储存环境干燥。