当甲、乙两种元素相互化合,能生成几种不同的化合物时,则在这些化合物中,与一定量甲元素相化合的乙元素的质量必互成简单的整数比,这一结论称为倍比定律。
精选百科
本文由作者推荐
倍比定律相关的文章
高脂蛋白血症是指血浆中胆固醇和(或)三酰甘油水平升高。高脂蛋白血症按病因分为原发性和继发性。原发性高脂蛋白血症的发生,与基因突变和环境因素有关。继发性高脂蛋白血症的发生,与全身性疾病、药物影响有关。高脂蛋白血症,主要是引起皮肤黄色瘤和动脉粥样硬化,表现为眼睑周围出现小黄粒;胸痛、气促、头晕、便秘、腹
《神雕侠侣》是作家金庸创作的长篇武侠小说,是金庸“射雕三部曲”系列的第二部(第一部为《射雕英雄传》,第三部为《倚天屠龙记》)。小说于1959年5月20日在香港《明报》连载,1961年完结。小说有“明报版”“修订版”两个版本,其中“修订版”包括1976年的修订本(后由三联出版社出版),和2003年的新
阿拉伯埃及共和国(阿拉伯语:جمهوريّةمصرالعربيّة,英语:The Arab Republic of Egypt),简称“埃及”。位于非洲东北部,地处欧亚非三大洲的交通要冲。南接苏丹,西连利比亚,东临红海与巴勒斯坦、以色列接壤,北经地中海与欧洲隔海相通,东南与约旦和沙特阿拉伯相望。海
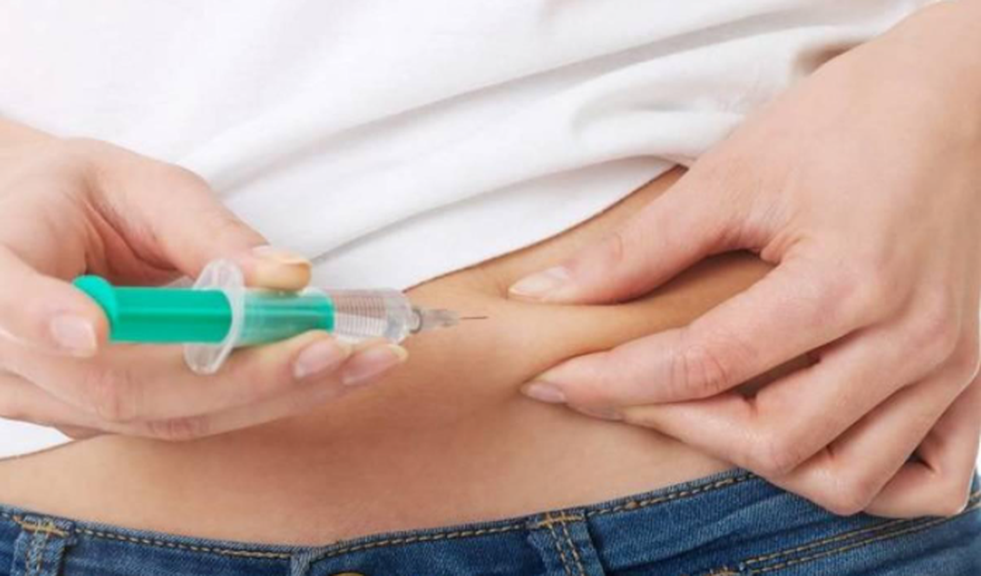
胰岛素蛋白质激素名称胰岛素(Regular insulin)可增加葡萄糖的利用,能加速葡萄糖的无氧酵解和有氧氧化,促进肝糖原和肌糖原的合成和贮存,并能促进葡萄糖转变为脂肪,控制糖原分解和糖异生,因而能使血糖降低。此外,本品能促进脂肪的合成。抑制脂肪分解,使酮体生成减少,纠正酮症酸血症的各种症状。能促进蛋白质的合成,抑制蛋白质分解。本品和葡萄糖同用时,可促使钾从细胞外液进入组织细胞内。

尚可名片
这家伙太懒了,什么都没写!
作者