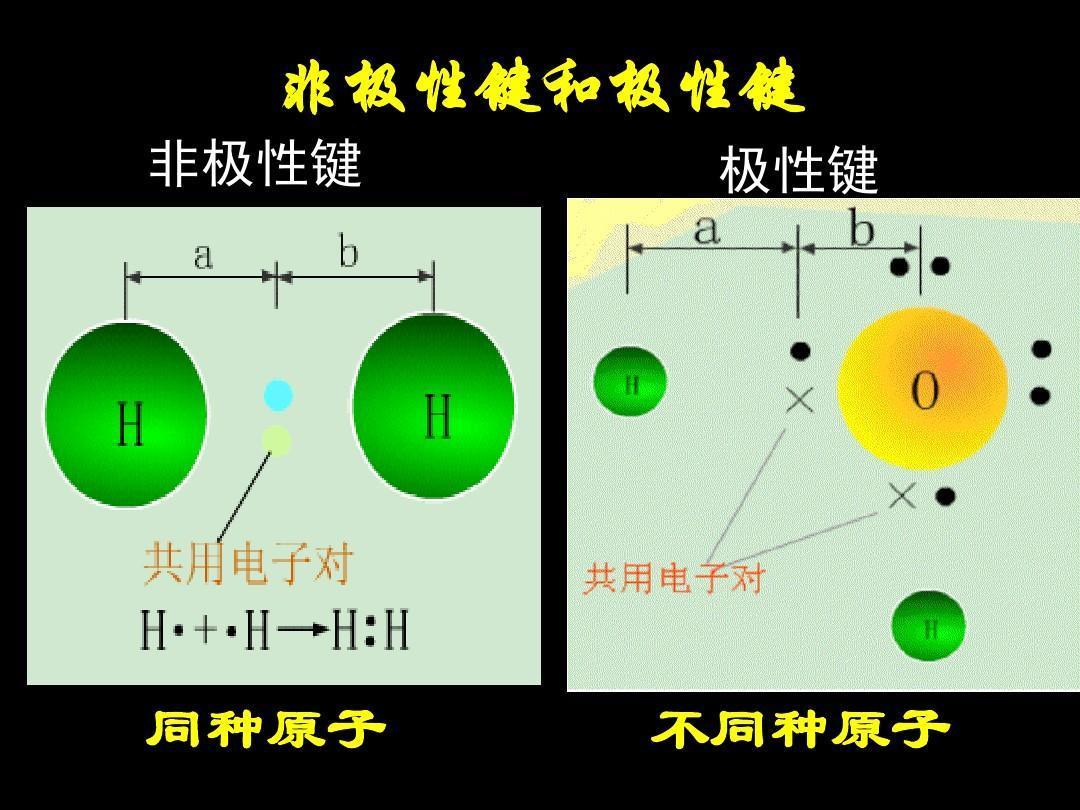
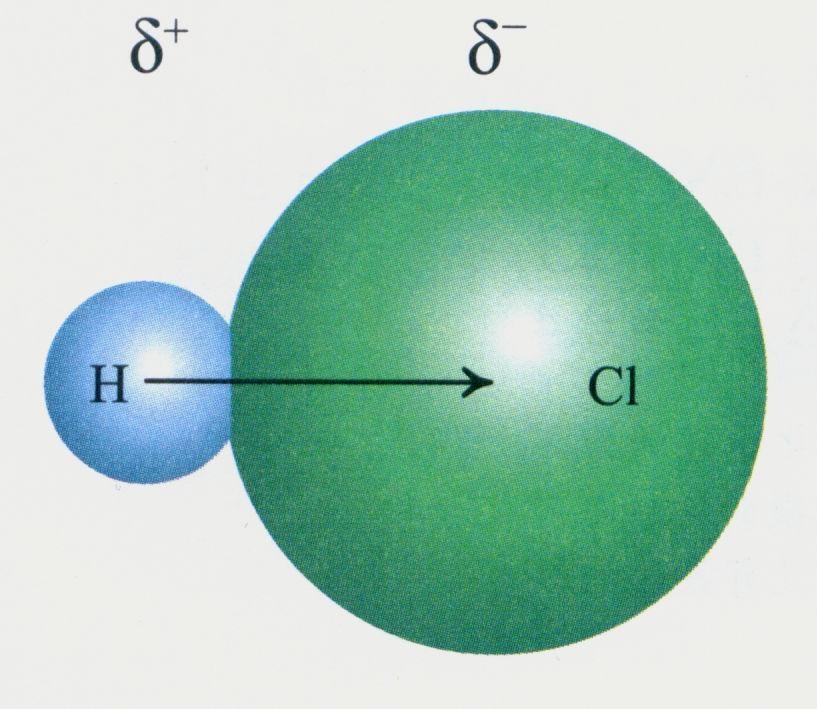
在分子中,同种原子形成共价键,两个原子吸引电子的能力相同,共用电子对不偏向任何一个原子,因此成键的原子都不显电性。这样的共价键叫做非极性共价键,简称非极性键。
非极性键相关的文章
小编整理:梅超风是金庸先生的原著《射雕英雄传》中的重要角色,她与丈夫陈玄风合称“黑风双煞”,是黄药师的弟子,也是黄药师最出色的徒弟之一。在《神雕侠侣》中,梅超风被金轮寺的达尔巴和潇湘子等人围攻而死。她有一套极为独特的武功“九阴白骨爪”,这套武功源自于《九阴真经
国际关系学主要是指研究国际关系行为体之间相互作用,各种国际体系运行和演变规律的一门科学或学问。是政治学的一个分支学科,主要研究领域为战争与和平、合作、一体化、国际组织等国际体系层面的政治现象。国际关系既是学术的领域,也是公共政策的领域。作为政治学的一部分,国际关系也和哲学、经济学、历史学、法学、地理
19世纪中叶,这是世界近代史阶段基本到来的历史时刻。因为,第一,工业革命在欧美主要国家完成或迅速发展,使得西方大工业生产力向全球传播,世界市场已经基本上形成。第二,西方的机制工业品,已经倾销到世界大部分落后国家和地区,亚、非、拉的许多国家开始产生或初步地发展了自己的近代资本主义经济,这样,除了亚、非
生产建设兵团是指新中国成立后陆续组建的各类生产建设兵团,是中国通过军垦这种特殊体制达到巩固边防,发展经济,安置人员的目的,兵团成为党、政、军权合一,工、农、兵、学、商五位一体的半军事化组织和社会经济体系,尽管如今只有新疆生产建设兵团存在,但是在那段激情燃烧的岁月里,全国却陆续出现过12个兵团,3个农
阿斯旺(阿拉伯语:أسوان),埃及南部城市,阿斯旺省首府,位于尼罗河东岸,人口约20万,著名古城、旅游景点和贸易中心。阿斯旺是世界上最干燥的地方之一,自2006年5月13日以来,阿斯旺没测得任何降水。在古埃及时期,阿斯旺被认为是埃及民族的发源地。它位于尼罗河第一瀑布以北,是埃及和努比亚之间的贸易重镇,其名据说是古埃及语“贸易”一词的对音。

尚可名片
这家伙太懒了,什么都没写!