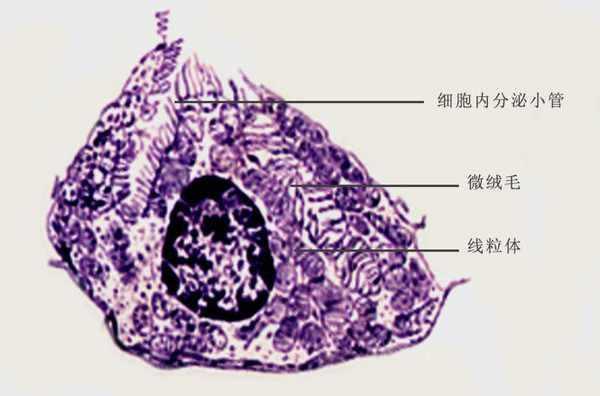
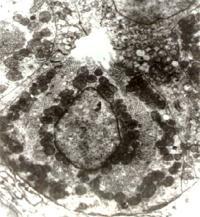
壁细胞是胃中的泌酸腺体,壁细胞(parietal cell)的超微结构:微绒毛,细胞内分泌小管,细胞核 胃粘膜中有三种外分泌腺:贲门腺、泌酸腺和幽门腺,其中的泌酸腺的腺体主要就有壁细胞、主细胞和颈粘液细胞,壁细胞能分泌盐酸和内因子。 壁细胞(parietal cell):又称泌酸细胞(oxyntic cell),在腺的颈、体部较多。此细胞较大,多呈圆锥形。核圆而深染,居中,可有双核;胞质呈均质而明显的嗜酸性。电镜下,壁细胞胞质中有迂曲分支的细胞内分泌小管(intracellular secretory canaliculus),管壁与细胞顶面质膜相连,并都有微绒毛。
精选百科
本文由作者推荐
壁细胞相关的文章
小编整理:孟广美(MengGuangmei),1967年12月1日出生于中国台湾省,中国台湾女演员、模特、主持人。-1985年,十八岁的孟广美到意大利念书,从事先修班,随后进入米兰模特学校就读。-1995年,进入演艺圈发展,参演的首部电影为意大利艾米利亚罗马涅
柠檬清新的香气,可以提神醒脑、振奋精神,缓解烦躁,净化空气。檬精精油 对于皮肤及身体也有很多积极的调理作用。柠檬精油中的柠檬烯特别有益于美白、收敛、平衡油脂分泌、治疗青春痘等油性皮肤症状。
希伯仑(阿拉伯语:الخليل;希伯来语:חֶבְרוֹן)是西岸地区(巴勒斯坦南部)的一个城市,位于耶路撒冷以南30公里,拥有166,000名巴勒斯坦人和700-800名犹太定居者。希伯仑海拔高度为930米。该市是犹太教中仅次于耶路撒冷的圣城。
北海(North Sea)是位于大西洋东北部的边缘海,位于欧洲大陆的西北,与须德海相对应。北海的西部以大不列颠岛和奥克尼群岛为界,北部为设得兰群岛,东邻挪威和丹麦,南接德国、荷兰、比利时和法国,西南通过多佛尔海峡和英吉利海峡与大西洋相通。北海的面积为57.5万平方公里,南北长965.4公里,东西宽6
星新一少年科幻安徽少年儿童出版社出版的图书《星新一少年科幻》是日本科幻之父星新一的科幻短篇精选集,各分册是《情感电视机》《梦之城》《妄想银行》《淘气的机器人》《你好,地球人》,除了收录作者各个时期的代表作品,还收录了入选语文教材和课外阅读的篇目。

尚可名片
这家伙太懒了,什么都没写!
作者