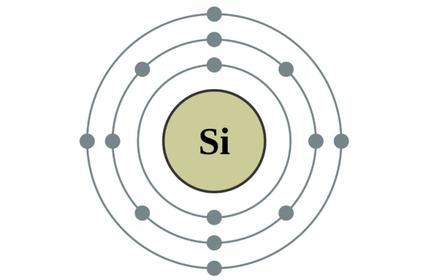
硅 硅是一种类金属元素,英文名Silicon,化学符号Si,原名矽,原子序数14,相对原子质量28.085,密度2.33g/cm³,熔点1410℃,沸点2355℃,是元素周期表上IVA族的金属元素 。硅有两种同素异形体:晶体硅和非晶硅。晶体硅呈钢灰色,非晶硅呈黑色。晶体硅是一种坚硬而有光泽的原子晶体,具有半导体特性。 硅具有活跃的化学性质,在高温下可与氧等元素结合。不溶于水、硝酸和 盐酸 ,溶于氢氟酸和碱液。 硅在自然界中广泛分布,很少以单质形式出现,主要以二氧化硅和硅酸盐的形式存在。它在地壳中约占26.4%,是地壳中仅次于氧的第二丰富的元素。 主要用于生产高纯半导体、耐高温材料、光纤通信材料、有机硅化合物、合金,广泛应用于航空航天、电子电气、建筑、轻工、医疗
基本信息
物理性质
蒸气压
1635℃时为1Pa;1829℃为10Pa;2066℃为100Pa;2363℃为1kPa;2748℃为10kPa;3264℃为100kPa
原子性质
氧化态
4, 3, 2, 1 −1, −2, −3, −4
发现历史
硅元素的发现历史 硅化合物的历史非常悠久,陶瓷是人类最早知道的硅化合物。为了增加器物的耐火性,会在器物表面粘上一层粘土,然后烧制。在一定温度下,其中的粘土会发生化学变化,变成玻璃相。但是,由于当时用木头烧纸的温度较低,只有少量的粘土会变成玻璃相。这些玻璃相结合其他矿物形成陶瓷
1789年,法国化学家拉瓦锡( Antoine Laurentde Lavoisier)发表了《化学基础论》并在其中提到:“我们用元素或者物体的要素(principles of bodies)这一术语来表达分析所能达到的终点这一观念。……那些我们所认为的简单的物质,……由于迄今尚未发现分离它们的手段,它们对于我们来说就相当于简单物质。而且在实验和观察证实它们处于结合状态之前,我们决不应当设想它们处于结合状态。”这就是最开始人们对于元素的定义,在这本书之前,人们将元素分为了四个大类,包括了 33种元素。对于土这种物质,人们把它当成元素对待,并分成了石灰、镁土、重土、矾土、硅土五种。其中把硅土命名为“Silice”,希腊语为“Silex”,意为“火石。一直到1870年,戴维(Humphry Davy)成功的从 苛性碱 中分离出了钠和钾后更加证实了拉瓦锡认为的“在实验证实它们处于结合状态之前,绝不应设想他们处于结合状态” 钠和钾的成功提取为人们提供了两种还原性较强的还原剂,也为后续硅的提取奠定了基础。1808年,大卫决定从硅土中提取新元素。然而,由于其独特的化学和物理性质,戴维误以为硅土是一种金属氧化物。他首先用强电流电解这些土壤。由于硅土熔点高,电解不能使其熔化。然后他尝试用钠和钾来还原,也没有成功。然而,尽管没有新的 1808年法国化学家盖·吕萨克(Joseph Louis Gay-Lussac)和泰纳尔( Louis Jac 1813年,贝采利乌斯( Jons JakobBerzelius)得在对矿石进行分类时,发现它们都有同一种物质组成,并把这种物质称为“硅酸盐”。并且断定他是一种未知元素的氧化物且只溶于氢氟酸。随后贝采里乌斯成功的利用钾把硅从四氟化硅中置换出来。随后,为了验证所得到的新物质,他将得到的无定形硅置于氧气中燃烧,生成二氧化硅,从而证明了他从硅土中提取到了 1854年,克莱尔·德维尔在进行电解制备金属铝的实验时,在 电解槽 的阴极中得到了一种具有金属光泽的灰色材料,即硅铝合金。当这种材料冷却时,析出的片状晶体称为晶体硅。对于这种晶体,德维尔认为它并不是金属,而是和石墨片近似。这种硅是具有独特结构的单质硅,与贝采利乌斯所得到的无定形硅是同素异形体。至此,硅的两种单质都被发现,硅元素的化学观基本成型了。
硅的应用发展历史 人类应用硅化合物的历史可以追溯到上古时期的制陶工艺。随着贝采利乌斯利用K还原 氟硅酸钾 ,得到较为纯净的无定形硅后,早在上古时期人们就已经利用硅氧化物来制陶。随着贝采利乌斯通过K还原得到无定形硅后,使得科学家对硅单质产生认识。而后由于硅所具有的优异的半导体性质构成P/N结,从而用作了集成电路的基底。随后前港中文大学校长高锟提出利用石英基纤维来传递信号会带来一场信息革命后,康宁公司在上世纪70年代研发出来了第一条可以实现光通讯的光纤,从此人们进入信息时代。
分布情况 硅在自然界中分布极广,地壳中的含量约为26.4%,仅次于 氧元素 ,其主要存在形式是二氧化硅和硅酸盐。如果说碳是组成有机生命体的重要元素,那么硅对于地壳来说也具有相同地位,在自然界中,沙石、土壤以及空气中的粉尘都有硅的存在 。
理化性质
物质结构 Si为金刚 晶系
四方晶系
c
5.44 Å
空间群
Fd̅3m
90.00 º
点组
m3̅m
90.00 º
原子数
8
90.00 º
a
5.44 Å
体积
161.32 ų
b
5.44 Å
带隙
0.61 eV
物理性质 有无定形硅和晶体硅两种同素异形体。晶体硅为灰黑色,无定形硅为深棕色粉末,密度2.33g/cm ,熔点1410℃,沸点2355℃,晶体硅属于原子晶体。不溶于水、硝酸和盐酸,溶于硝酸和氢氟酸的混合物以及碱。硬而有金属光泽。
化学性质 硅有明显的非金属特性,可以溶于碱金属氢氧化物溶液中,产生(偏)硅酸盐和 氢气 。 由于硅的最外层有四个电子,处于亚稳态,因此化学性质稳定,常温下很难与其他物质(除硝酸与氟化氢的混合液和碱液以外)发生反应。高温下可以与一些单质气体反应(O 2 、Cl 2 、F 2 ) ,也可以与一些氧化物反应(硅热还原法炼镁) 。
(1)与单质反应
(2)高温真空条件下可以与某些氧化物反应
(3)与硝酸和氢氟酸的混合液反应
(4)与碱反应
制备方法 从1975年开始,大量的研究工作集中
挥发性硅化合物的还原和热解 这种方法涉及许多基于气相提纯冶金级硅的工艺,基本上是氯氢化物技术的改进。
(1)硅烷作为中间体的方法 该工艺的基础是通过 三氯硅烷 将冶金级硅转化为硅烷。副产品sicl4和h2可以回收利用。该工艺的第一步是通过SiCl 4 和H 2 与粉碎的冶金级硅(500°C, 30 MPa,催化剂)反应合成三氯硅烷: 第二步是 二氯硅烷 歧化生成硅烷,然后将中间产物和最终产物(60°C, 0.3 MPa,催化剂)进行精馏 第三步是硅烷热解,生成高纯度硅(800-1000℃):
热解通常在密闭空间反应器(均质热解)中进行,或在 流态化固体 反应器中使用硅种子。常规管状仪器也可使用。由于低工艺温度和几乎100%的回收率,由此产生的电子级硅的成本显著降低。
(2)二氯甲硅烷作为中间体的方法 该工艺的主要步骤是在改进的管状装置中热解二氯硅烷。二氯硅烷是由SiCl 4 氢化和SiHCl 3 歧化制得的。因此,初始步骤与硅烷工艺相同,最终步骤与三氯硅烷工艺相同。从纯化的SiH 2 Cl 2 中,硅的回收率为40%。这个过程包括三个主要步骤:
烷氧基硅烷工艺比 氯化物 -氢化物工艺在环境上更安全,因为没有任何反应中间体有毒或具有侵略性。
氟化工艺 氟化工艺往往被视为一个单独的类别,因为作为这些工艺的原材料,可以使用生产磷酸和含H 2 SiF 6 和SiF 4 的 磷肥 的低成本副产品。在废物处理中,硅通常以Na 2 SiF 6 的形式浓缩,Na 2 SiF 6 是SiF 4 的前体,SiF 4 4被金属钠还原。因此,过程包括以下步骤: 过滤和干燥后,Na 2 SiF 6 在450℃下分解:
提纯后的SiF 4 在400~500℃下用液态钠还原:
生成的混合物通过在水溶液中浸出或加热到1440°C以上(高于硅的熔点)来分离。过量的氟化钠可用于 冰晶石 的生产。这样得到的硅中的硼和磷含量不超过1ppm。在还原之前,SiF 4 通过在300°C的氟化钠上吸附、在−80-90°C下冷冻或使用活性碳来提纯。这样,SiF 4 的杂质含量可降低到1ppm。
冶金级硅的精炼 冶金级硅是通过传统碳热法进行商业规模生产的(用于冶金和其他应用)。半导体级硅(KRP)用于电子应用,也用作生产三氯硅烷的原料。半导体级硅中受限制的杂质有Fe、Al、Ca、Ti、B和P.从冶金级材料制备低成本太阳能级硅长期以来一直引起广泛的研究兴趣。相当大的努力旨在用更简单、更便宜但足够高效的净化工艺取代复杂、昂贵的三氯硅烷工艺。为此,有人建议使用冶金工艺,而不是蒸汽相净化,这提供了高生产率和低成本的优势。这种工艺被用于提纯商用硅。
由于冶金过程在去除杂质方面是相当有选择
(1)硅的湿法精炼 通过酸处理的湿法冶金精炼通常被用作提纯冶金级硅的第一个基本步骤。该工艺成本低,设备简单。众所周知,多晶硅中的大多数杂质,特别是金属,由于偏析系数低,因此在硅中的固溶性较低,所以沿晶界集中。鉴于此,要将需要精炼的硅研磨到40μ m一下。此外,为了优化工艺,可以利用不同酸的组合以及不同温度和浓度进行提炼 。总的来说,酸处理能使金属杂质含量降低一个数量级以上,偶尔也能降低两个数量级以上。铁、铝和钙这种杂质容易去除,镁、锆和镍不容易去除。该过程在去除B、P、C和Cu方面效果较差。与此相关,需要火法冶金过程(气体和液体萃取)来去除分布在硅内部的杂质 。
(2)气体萃取 气体抽提是冶金级硅提纯中最重要的火法冶金工艺之一。常用的方法是将硅熔化后向内部吹气,从而使得活性气体与杂质发生反应并被气流带出,实现精炼的目的。常用的活性气体是氯、氧和它们的混合物。铝、镁、锰和硼这些杂质在1400℃以上的条件下可以与 氯气 反应生成具有挥发性的氯化物。 氢气、 一氧化碳 、二氧化碳和四氟化硅也被用于气体萃取。硼杂质可以被氢气反应带走,磷和碳可以被二氧化碳反应带走。硼、铜、钙以及锰杂质可以被四氟化氢反应为挥发性氟化物从而被带走去除。用SiF 4 + CO混合物处理会形成挥发性过渡金属羰基,如Ni(CO) 4 。在冶金级硅的商业规模生产中,气体萃取通常用于降低铝和钙的浓度,并且可以很容易地与其他冶金净化工艺相结合。
(3)液体萃取 该方法采用CaCO 3 -BaO-MgO、Al-SiO 2 、CaO-SiO 2 、CaF 2 -SiO 2 等熔渣处理液态硅。净化效率取决于 炉渣 的成分,这个方法利用了杂质在熔渣中和熔融硅中的溶解度不同,从而实现精炼的目的。添加炉渣的质量分数通常在硅的5-30 wt %范围内 。 在炉渣处理过程中,与氧气更易结合的杂质置换进炉渣。该工艺有效地去除了Al, Mg, Ca, B, P, Ti, Mn和V。平均而言,杂质浓度降低了一个数量级以上。该工艺对于降低太阳能级硅制备过程中的B含量时很好的选择。
(4)Al-Si系的再结晶 铝在相对较低的温度下容易溶解硅和固体夹杂物,提供高效的结晶精炼,而且价格低廉。该工艺的主要步骤是将硅粉(和杂质)溶解在铝中;冷去后利用硅不与酸反应的特点,将铝和杂质用酸去除从而得到较高纯度的硅。重结晶是一种相对廉价和有效的工艺,适用于去除B、P、Fe、Ca、Ti、Cu、Cr和M。 将这一工艺与液态(渣)提取相结合,可以显著提高冶金级硅的纯度。杂质浓度可降低到以下水平(Ppm):Al<1;Fe<1.1;B<2;P<2;以及Ti<0.5。通过随后的定向凝固,金属杂质的浓度可以进一步降低至少一个数量级。
(5)定向凝固 这一步是硅精炼的最重要的一步,它决定了所制得的硅是否达到太阳能级。它还允许净化过程与不同技术的晶体生长相结合。
二氧化硅的碳热还原 二氧化硅的碳热还原的过程可以用这个反应式进行表达:
该方程描述了整个反应过程,实际上涉及到作为反应中间体的SiC和SiO气体的形成。自由硅是SiO和SiC在1900°C以上反应产生的:
碳热还原过程的一个值得注意的特征是气相主要由SiO和CO组成。这一过程伴随着明显的SiO形式的硅损失,根据还原剂的性质和 石英岩 的质量(还原能力),损失可能高达10%-30%。
应用领域
1、重要的半导体材料 在单晶硅中掺杂不同的元素,可以形成p型半导体和n型半导体,例如在硅中掺杂少量的硼元素可以形成P型半导体,这种半导体是因为硼最外层有三个电子,与硅结合后会使得硅中留下一个电子空穴,从而使得硅变得更易与电子结合;在硅中掺杂磷元素可以形成N型半导体,这是由于磷是第Ⅴ族元素,它 最外层电子数 是五,与硅晶体结合后会留有一个活泼的单电子。当这两种半导体结合后会构成P/N结,这种结构可以用于太阳能电池,将光辐射能转化为电能。 此外硅也广泛用于制作二极管、集成电路这些元件中。
2、在航天航空中的应用 现代科技的飞速发展对高温环境下应用的各种材料提出了越来越高的要求,既要在高温下保持很高的强度、硬度,又必须抗氧化、耐腐蚀和承受温度剧变。金属陶瓷是介于高温合金和陶瓷之间的一种高温材料,它兼顾了金属的高韧性、可塑性和陶瓷的高熔点、耐腐蚀和耐磨损等特性,在航空航天、温度测量、核能及加工制造等领域中拥有广阔的应用前景。
此外在飞机运行的服务期间,侵蚀引起的退化是常见的。而 铝硅合金 (Al–Si),由于其高比强度和低密度,广泛应用于需要轻金属的航空领域。
3、光导纤维 光导纤维是以二氧化硅为原料所制备成一种可以将光信号通过全反射实现信号传导的一种材料,在通信领域中光导纤维传递到信息量更高,而且具有高度的保密性。除了通信技术领域外,光导纤维也在医学,照明等领域有着广泛应用。
4、农业上的应用 适宜浓度的硅可以提高杂交水稻叶片中 叶绿素 和 类胡萝卜素 的含量,使得叶绿体增大,基粒增多,提高 光合速率 ,提高农作物根系活力和 根氧化力 ,满足根系生长需求。 硅还会影响农作物的 蒸腾作用 ,使得农作物具有抗倒伏、抗干旱的能力。 硅能维持农作物生理代谢的环境稳定,提高农作物的抗盐性。添加硅元素可以抑制盐胁迫环境下水稻对Na 的吸收,促进对营养元素(P、K、Ca)的吸收;可以降低盐胁迫下水稻叶片 丙二醛 的含量,使水稻根系的活力增强。 硅元素协助农作物抵御病虫害的侵袭,不仅有效而且无污染。农作物吸收硅后可以缓解细菌和真菌对农作物造成的危害,比如水稻易得的稻瘟病、纹枯病、胡麻叶斑病和白叶枯病;黄瓜、小麦、草莓等易得的白粉病。
硅改善农作物营养元素的吸收与分配,减少化肥对农作物的不良影响,为了降低氮肥、磷肥施入过多对农作物造成的贪青、倒伏和减产等现象,可以减施 氮磷钾 ,增施硅元素,促进主动吸硅植物对氮、磷、钾的吸收,并优化其在各器官中的分配比例。
安全事宜 硅是人体必需的微量元素之一。占体重的0.026%。饮食中硅明显缺乏就可造成骨的形成障碍,这种作用可在长期不经肠道进食的儿科病人身上观察到。另外,应考虑的是,硅的缺乏可影响胶原的形成和外伤病人的痊愈。
过量表现 大多数硅的化合物口服是无毒的,不过饲含高硅植物的反刍动物可发生含硅的 肾结石 ;人的肾结石内也可能含有硅酸盐。
每日摄入量估计量 尽管尚不知道硅的特殊生化功能,但动物试验的结果提示人体需要硅。然而,要提出一个合适的每日硅摄入量是困难的,因为没有适当的人体实验资料,有用的动物实验资料也有限。动物性膳食含硅大约16.76 MJ/kg。人进食这样的食物平均每日硅的摄入量为8.37 MJ/kg~10.46 MJ/kg,因此,根据动物实验的资料,假如饮食中的硅有高的可吸收性和有效性,那么,人每日硅需要量就相当小,即2 mg~5 mg,不过由于大部分饮食中的硅是无法直接被吸收的,并且衰老和低雌性激素也会抑制硅的吸收,所以每日摄入量应大于2 mg~5 mg。根据FDA计算每日饮食硅摄入量女性在19 mg,男性40 mg,根据人体调节平衡的资料显示,每日摄入量应在21~46 mg,英国
急救措施 眼睛:立即冲洗 - 如果这种化学物质接触眼睛,请立即用大量水清洗(冲洗)眼睛,偶尔抬起下眼睑和上眼睑。立即就医。
呼吸:新鲜空气 - 如果一个人吸入大量这种化学物质,请立即将暴露的人转移到新鲜空气中。其他措施通常是不必要的。
吞咽:立即就医 - 如果吞咽了这种化学物质,请立即就医。
消防安全 单质硅在暴露于火焰或与氧化剂发生化学反应时易燃。在气态氯中自发燃烧,硅与 钠钾合金 反应生成 硅化钠 ,在空气中自燃。硅、铝和 氧化铅 的混合物在加热时会爆炸。当三氟化锰在玻璃中加热时,玻璃中会发生涉及硅的剧烈反应。与 氟化银 急剧地发生反应。硅如果以粉末或颗粒形式与空气混合,则可能出现 粉尘爆炸 。如果干燥,可以通过旋转、气动运输、浇注等方式进行静电充电。最小爆炸浓度为:160g/m³。根据OSHA标准,允许硅粉尘暴露限值为:15 mg/cu m. /总粉尘/,允许接触限值为:5 mg/cu m. /可吸入部分/。