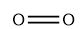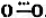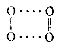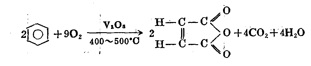氧气
氧气的结构式
氧气(英语:oxygen)是一种单质氧化剂,分子式为O₂,在空气中约占21%(体积分数),标准状况下为无色、无味气体,密度略大于空气,微溶于水。在101kPa下,当温度为-183℃时,氧气液化凝聚为液氧,呈淡蓝色液体,当温度为-218℃时,氧气则变成淡蓝色的雪花状固体。常温下化学性质较为稳定,与许多物质都不发生反应,但高温下化学性质活泼,可与多种元素直接发生氧化反应,这也与氧的电负性仅次于氟有关。纯氧不易燃,但助燃效果好。当长时间暴露在高温下或与火接触时,氧气瓶可能会破裂并发生爆炸。氧气被广泛用于医疗保障、化工生产、国防行业等领域,以及对于维持人类和动植物体的正常生命活动至关重要。 基本信息
性质
危险性
NFPA 704
氧气
健康危害等级:3(可能造成严重或永久性伤害)
易燃等级:0(在典型的火灾条件下也不会燃烧。)
不稳定性等级:0(即使在火灾条件下,通常也很稳定)
特殊性:具有氧化性
发现历史
关于氧的记载最早出现于公元4世纪:“把铜精灵和水银揉和在一起,就能释放出气体状的物体。”即当将某一化合物置于水银上加热时,就可观察到气体(氧气)的产生。
卡尔舍勒
1773年,瑞典药剂师卡尔舍勒将含有一小块磷的密闭烧瓶置于正在燃烧的蜡烛跟前,发现瓶中的白磷立刻熔化,并在几秒钟后爆发出明亮的火焰,产生大量浓雾沉积在瓶壁上,像是一层白霜。烧瓶冷却后,他将瓶口朝下放进水中,并在水中拔去瓶塞发现,水由下而上涌进烧瓶之中的休积,正好是原空气体积的1/5,并且瓶内剩余气体不再支持燃烧,他称其为“死空气”。后续实验中,他将几只老鼠关到装满了这种“死空气”的罐子中,发现老鼠很快被窒息而死。后来,舍勒发现用浓硫酸加热硝石(硝酸钠)时,可产生一种可燃气体,他将即将熄灭的炭置于该气体中,发现炭立即迸发出白色火焰。他发现除硝石外,以水银的红色氧化物为原料进行加热也能产生氧气。但舍勒的发现直到1777年才公诸于众。 约瑟夫普利斯特
英国化学家约瑟夫普利斯特里将一盆花和一支燃烧的蜡烛同时置于密闭空间内,发现烛光很快熄灭了,但几小时过后,花竟然一点儿也没枯萎,把它放窗台上,一夜过后,花仍然鲜艳夺日,绿叶葱葱。经过大量实验,他证明植物吸收“固定空气”(即二氧化碳气体),而放出“活命空气”(即氧气)。这种“活命空气”维持着动物呼吸,并能使物质燃烧的更加剧烈。1774年,他利用大凸透镜聚焦太阳光加热三仙丹(HgO)时,发现产生了气体和汞珠,并且该气体相比于空气,可使红热的木炭燃烧得更加剧烈,并发出明显光亮。此外,他将点燃的蜡烛置于该气体中,发现蜡烛不仅燃烧正常,而且相比于空气中更加的耀眼。并且该气体支持呼吸的功能相当于普通空气的5-6倍。。由于普利斯特里是从金属锻灰中分离产生氧气,恰好为燃素(可燃的要素,是一种气态的物质,存在于一切可燃物质中)的对立物,因此,对化学发展具有重大意义,他也被现在化学界多数人认为是第一个发现氧的人。虽然舍勒和普里斯持利都单独发现并制得了氧气,但由于他们被传统的燃素说所束缚,被称为是“当真理碰到鼻尖上时还是没有得到真理。 拉瓦锡
1775年,法国化学家拉瓦锡在密闭的曲颈甑中将少量水银连续加热12天发现,水银沸腾后产生了一部分变成红色鳞状物质(氧化汞),同时玻璃罩内的空气体积减少了1/5左右。他将点燃的蜡烛和小老鼠分别放入玻璃罩,发现烛火立即熄灭,同时小鼠也因窒息而死。他再对水银产生的氧化汞进行加强热,得到了水银和一种气体,并且该气体的体积与先前玻璃罩内减少的空气体积相等。他将产生的气体与玻璃罩内的剩余气体混和发现,其性质与空气的性质相同。他将该气体命名为氧,并通过实验,提出了氧化学说,推翻了燃素说,并被恩格斯称为“真正发现氧气的人”。 命名历史
公元8世纪时期,在《平龙认》中最早将氧气称为阴气,并提出制备方法。1661年,英国化学家波义耳将氧气称为有助于燃烧的“活化蒸汽”,1773年,瑞典药剂师卡尔舍勒根据其发现过程将氧气命名为“火焰空气”,1774年,英国化学家约瑟夫普利斯特将氧气命名为“脱燃素空气”(也曾称为“活命空气”),1775年,法国化学家拉瓦锡锡将这种极纯气体命名为Oxygen,这也是现代氧气英文名字的起源。 分布情况
氧气在空气的体积分数约为21%,质量分数约为23%。大气中氧气的分布与海拔高度有关,海拔高度越高,氧气越稀薄,因样,水中氧气的分布也并不均匀,呈现下层少,上层多的状况。此外,由于绿色植物可通过光合作用将二氧化碳和水转变为有机物质和氧气,因此,在森林等绿色植物较多的地方空气中的氧气含量更高。 物质结构
氧气
氧气由氧分子(O₂)构成,每个氧分子由2个氧原子通过共价键结合形成,共价键中,一个2p轨道形成σ键,另两个2p轨道形成三电子π键,其价键结构和分子轨道电子排布式分别为 在π轨道中有未成对的单电子,因此,氧气是所有双原子气体中唯一同时具有奇数电子和顺磁性的气体。但经光谱实验发现,氧气中还存在一种抗磁性物质O₄,有尤其在固体氧中存在较多。一般认为O₄是由O₂缔合而成,其缔合式可能为
缔合能为0.54kJ/mol,远小于正常的O-O键能(138kJ/mol),因此,非常容易解缔。此外,氧分子的离解能较大,破坏共价键所需能量较大,导致氧气在常温下的反应性能较差。
液氧中存在缔合分子O₄,在加温、加压下,经分子光谱实验证明其具有反磁性。
单线态氧和三线态氧
根据分子轨道理论,基态氧分子的两个单电子分别占据两个轨道且呈自旋平行状态,在适当强度的磁场作用下,其在原子吸收和发射光谱中有(2S+1)谱项,由于自旋平行时S=1,所以,(2S+1)=3,即自旋多重性为3,基态氧分子为三重态,又称三线态氧。当基态氧分子被激发后,两个电子不论是以自旋相反的状态占据同一个π轨道,还是以自旋相同态分别占据两个π轨道,其均为S=0,(2S-1)=1,即自旋多重性为1、激发态氧分子为单重态,又称单线态氧。单线态氧的氧化能力高于三线态氧,空气中的氧气多数为三线态氧。基态氧分子不能直接吸收光能产生单重态氧,但可以通过光敏化法(常用的光敏化剂为荧光型染料,如,荧光黄、亚甲基蓝、叶绿素等)和化学方法(过氧化氢和次氯酸根离子在乙醇中反应)等得到单线态氧分子。 生理作用
人体生命活动
从外界摄取氧气,再从体内排出二氧化碳的过为成人体新陈代谢的循环过程。人体从外界呼吸的氧首先进入肺泡,弥散到肺部的毛细血管中,与血红蛋白结合成氧合血红蛋白,再在心脏作用下携带氧的血液由动脉输往全身,当到达毛细血管时,氧合血红蛋白解离出氧并携走二氧化碳,这时由氧合血红蛋白解离出来的氧为溶解氧,进入细胞。与糖、蛋白质、脂肪作用产生热量释放机械能,为人体生命活动提供能量。 此外,人体的皮肤也在呼吸,即在皮肤组织内燃烧糖,把它分解成二氧化碳和水,于此同时通过汗孔与外界空气进行交换。通过皮肤呼吸散发热、排泄有害物质、蒸发水分等。虽然皮肤呼吸量仅是肺呼吸量的1%,但只要皮肤呼吸停止40分钟就可能会导致人体死亡。
植物体生命活动
与人体不同,绿色植物既能消耗氧气,又能产生氧气。绿色植物通过光合作用,利用太阳辐射能在水的参与下将二氧化碳转换为碳水化合物,并放出氧气,而在进行呼吸作用时,吸收氧气将体内一部分碳水化合物氧化还原为二氧化碳放出,同时把在光合作用时固定的能量的一部分重新释放出来、因此,呼吸作用是光合作用的逆反应,白天,光合作用与呼吸作用是同时进行的;夜间,光合作用停止,只存在呼吸作用。
动物体生命活动
水生动物
水中氧含量只有空气中氧含量的5%,而且氧在水中的扩散速度更慢一些,所以对于水生动物来说,它们拥有比陆生动物更有效的呼吸器官,即,水生动物通常靠鳃吸入氧气维持生命活动。
陆生动物
无尾两栖类动物通过肺和皮肤进行呼吸,肺内壁呈蜂窝状,但肺的表面积不大,因此,皮肤呼吸仍占重要地位。爬行动物的肺虽然和两栖类一样为囊状,但其内壁有复杂的间隔,把内腔分隔成蜂窝状小室,使其与空气接触的面积增大。肺的结构在不同的动物体内变异很大,最简单的形式仍为一囊。
同素异形体
氧气的同素异形体有臭氧(O₃)、四聚氧(O₄)、八聚氧(O₈),其中臭氧最为常见。与氧气不同的是,臭氧在标准状况下为浅蓝色气体,有鱼腥臭味,具有反磁性。常温下可缓慢分解。实验室中,控制温度为7℃,在氧气中进行无声放电,可将氧气转变为臭氧,并且所制的臭氧的浓度可达10%。此外,当大气中产生雷电火花时也能得到少量臭氧。 理化性质
物理性质
标准状况下,氧气为无色、无味气体,熔点-218.8℃,沸点-183.1℃,密度略大于空气密度,为1.429g/L。氧气为非极性分子,不易溶于水,20℃时,溶解度为30cm³氧气/dm³水,氧气在盐水中的溶解度略小于纯水中,但氧气在许多有机溶剂(如乙醚、CCl₄、丙酮、苯等)中的溶解度比在水中的溶解度高10倍左右。在101kPa下,-183℃时,氧气经凝聚变为液氧状态,呈淡蓝色,且具有流动性,当进一步冷却至-219℃时,氧气则凝聚形成淡蓝色的雪花状固体,但氧的液体和固体形态均具有明显的顺磁性。 化学性质
氧气具有强氧化性和助燃性。在常温下化学性质较为稳定,仅能氧化一氧化氮、氯化亚锡和亚硫酸等强还原性物质,但在高温时化学性质较为活泼,除卤素、稀有气体和Au,Pt、Hg、Ag等少数贵金属外,能直接与其它元素发生氧化反应生成氧化物M₂O,并放出大量热,当金属元素的活泼性较强时,则可反应生成过氧化物或超氧化物。室温下,氧气可以氧化E(θ)<0.6V的还原剂(如S³⁻、SO₄²⁻等)。在适当条件下,氧气可与许多无机物(如硫化氢、一氧化碳、硫离子等)及所有的有机物直接反应,或在热、光、放电等外界条件催化下反应。几乎所有的有机化合物均能在氧气中剧烈燃烧生成二氧化碳和水。 与无机物反应
分类 | 无机物 | 化学方程式 | 反应现象 |
金属 | 钾 | | 钾被氧化生成氧化钾,表面变暗 |
| 燃烧条件下,氧气与钾反应生成过氧化钾 |
| 生成超氧化钾 |
钠 | | 钠的光亮表面在接触到空气(氧气)后很快变暗,生成氧化钠 |
| | 点燃时,钠燃烧产生黄色火焰,并放出大量的热,生成淡黄色粉末,即过氧化钠 |
镁 | | 镁剧烈燃燃发出耀眼的强光,放出大量热,生成白色粉末状固体,即氧化镁 |
铝 | | 铝燃烧发出的光,并放出热量,生成白色固体氧化铝 |
铁 | | 加热条件下,铁与氧气反应生成红棕色粉末,即氧化铁 |
| 铁丝剧烈燃烧,放出大量热,并生成黑色固体,即四氧化三铁 |
铜 | | 加热后,铜与氧气反应生成黑色固体,即氧化铜 |
非金属 | 氢气 | | 氢气燃烧,产生淡蓝色的火焰,生成水并放出大量的热 |
碳 | | 氧气充足时,碳燃烧剧烈,发出白光,并放出热量,生成使澄清石灰水变浑浊的气体二氧化碳 |
| 氧气不足时,碳与氧气反应生成一氧化碳 |
硫 | | 硫在空气中燃烧产生微弱的淡蓝色火焰;在纯氧中燃烧发出蓝紫色火焰,生成有刺激性气味的气体,并放出热量 |
白磷 | | 白磷在充足氧气中燃烧,产生黄色火焰,并生成白色粉末状固体,即五氧化二磷 |
氮气 | | 氮气与氧气可在放电条件下反应生成一氧化氮 |
化合物 | 硫化氢 | | 氧气充足时,硫化氢在氧气中燃烧剧烈,生成水和刺激性气体二氧化硫 |
| | 氧气不足时,硫化氢与氧气反应生成硫单质和水 |
| 硫化亚铁 | | 该反应即为煅烧黄铁矿的过程,生成红棕色粉末(氧化铁)与刺激性气体(二氧化硫) |
| 二氧化硫 | | 在氧化钒催化并加热下,二氧化硫与氧气反应生成三氧化硫 |
| 氨气 | | 氨气在纯氧中燃烧生成氮气和水 |
| | 在铂催化并加热下,氨气与氧气反应生成一氧化氮和水 |
与有机物反应
有机物 | 化学方程式 | 备注 |
烃类 | | 气态烃类在氧气中燃烧通常发出明亮的蓝色火焰,放出大量的热,生成水和能使澄清石灰水变浑浊的气体 |
甲烷 | | |
乙烯 | | |
| 以Co(Ⅱ)、Ni(Ⅰ)、V(V)、Fe(Ⅲ)、Mn(Ⅰ)的配合物为催化剂,氧气可以与烯烃和环烯发生环氧化反应;用N-羟基邻苯二甲酰亚胺、吡啶和Mn(Ⅰ)的四苯基卟啉氯化物将氧气活化后,可以将苯乙烯、环已烯、1,2-二苯乙烯环氧化;向有位阻的烯烃中加入催化量氮氧化物(NO₂,NO,NO)后,可以被氧气环氧化;在锌粉存在下,以溶于丙酸和1,2-二氯乙烷的三氯化铕为催化剂,氧气可以将1-己烯环氧化 |
乙炔 | | |
苯 | | |
| |
碳氢氧化合物 | | |
甲醇 | | |
乙醇 | | |
| |
脂肪 | | |
氯仿 | | |
制备方法
光合作用
绿色植物可通过吸收光能将二氧化碳和水转变为有机物和氧气。
实验室制法
因为在氧化物或含氧酸盐中,氧的氧化态为-2价,所以可通过化学方法将O²⁻氧化为零价氧的方法制取氧气。如加热氧化汞等金属氧化物、过氧化钡等过氧化物和硝酸钠等均可制备氧气。实验室最常用的主要为加热高锰酸钾、过氧化氢和氯酸钾三种方法。 高锰酸钾法
高锰酸钾法通过加热高锰酸钾,使其受热分解产生氧气,具有制备时间短、操作简便和便于收集的特点:
过氧化氢法
过氧化氢法通过二氧化锰催化加速过氧化氢分解速产生氧气: 氯酸钾法
实验室中最常用的方法是以二氧化锰为催化剂,使氯酸钾加热分解。即,在二氧化锰作用下,当加热至200℃时,氯酸钾分解产生氧气。
工业制法
分离液态空气法
分离液态空气法利用氧气和氮气的沸点不同,从空气中分离制备氧气,是一种物理制取氧气的方法。首先,清除空气中的灰尘和机械杂质。由于液态氮的沸点(‐196℃)低于液态氧的沸点(‐183℃),更容易通过蒸发除去,因此,当在低温条件下,通过加压使洁净空气转变为液态后,可通过蒸发将氮气从液态空气中除去,从而获得较为纯净的液态氧,该方法可制备得到纯度高达99.5%的液态氧。为了便于储存运输和使用,通常将制得的氧气加压后贮存于蓝色钢瓶中。 膜分离技术
膜分离技术指在一定压力下,让空气通过具有富集氧气功能的薄膜来制备氧气,该方法制备得到的氧气纯度可达到90%以上。该方法使用时首选的膜材料必须同时具有高渗透性和对氧气的高选择性。 水电解法
在电解槽中通直流电,其中的水经电解作用可产生氧气和氢气,但该方法主要产物为氢气,而非氧气。 变压吸附法
变压吸附法指在高压下,将压缩空气通入吸附床,利用沸石对氮气和氧气的选择性不同,以及氧气的分压较低的特点,去除空气的氮气,并且在出口处获得富氧空气。过一段时间后,可通过降低压力的方法去除吸附床上吸附的氮气数量,增大吸附能力,进而提升出口处的氧气纯度。 检测方法
常用的氧气检测方法有电化学氧气传感器、伽伐尼电池测氧仪、顺磁测氧法、光学氧气传感器和 气相色谱法等。
应用领域
医疗保障
富氧空气或纯氧在临床医疗中用于治疗各种类型的缺氧、呼吸困难以及任何其它大量消耗氧气的疾病,如用于治疗呼吸系统疾病、一氧化碳中毒等疾病,以及当误吸(化学性肺炎)或吸入有毒气体可能导致肺损伤,进而导致正常氧合受损时,需要辅助供氧。此外,氧气在潜水、登山、航天飞行等方面对于保障人体正常活动也非常重要。 化工生产
化学工业中,氧气可用于生产制备过氧化钠、氧化铅、硫酸、硝酸和磷酸等物质,还可直接氧化乙烯生产环氧乙烷、合成气(H₂+CO)、纸浆漂白、污水处理、渔业养殖等领域。此外,氧的同位素之一¹⁸O常作为示踪原子(试剂H₂O¹⁸)用于化学反应机理的研究。 炼钢工业
大量的纯氧用于炼钢,炼钢工业耗氧量占氧生产总量的60%以上,氧气可用于制备光导纤维和半导体器件、工艺中热氧化、金属焊接和切割、熔炼和顶吹氧炼钢等,此外,氧焰和氧炔焰常用于切割和焊接金属等。氧气还可在炼钢时用于除去Na、P等杂质。 国防行业
氧气用作卫星发射及宇宙飞船中火箭燃料的氧化剂,液氧可用于制作液氧炸药和作为火箭发动机的助燃剂等。 生命活动
氧气是维持生命体的正常活动、燃烧和氧化过程的重要因素。生物体内利用吸入的氧气进行缓慢氧化反应为产生的能量维持生命活动,如果供氧低于正常水平,人会变得懒洋洋甚至失去知觉。
安全事宜
储存运输
氧气储存在压力为150-160atm的气瓶中,液氧储存在绝缘罐中,少量液氧(2-50升)也可以储存在杜瓦瓶中。并将氧气容器放置于干净、阴凉、通风良好、远离火源、温度低于30℃的火灾风险低的地方,并与还原剂、易(可)燃物、活性金属粉末等分开存放,同时配备泄漏应急处理设备,氧气瓶(天蓝色,黑字)上的塑料压碎垫圈要及时更换,切记重复使用,并且禁止使用油或油脂润滑氧气瓶上的阀门。 消防措施
当火势较小时,使用干粉或二氧化碳灭火器进行扑灭;当火势较大时,使用水、雾或普通泡沫灭火器进行扑灭。氧气本身不易燃,但可助燃,因此,当氧气与易燃物接触时,应先将该区域与火源隔离开来,随后使用适宜的灭火剂进行扑灭。此外,若着火区域的易燃物均为水溶性物质,可通过用水稀释易燃物来降低着火强度。 将重大泄漏或溢出情况通知安全人员,在保证安全的情况下,排查消除所有点火源,关闭氧气源,并喷洒大量水以提高受控蒸发率,此时可能产生大量雾降低能见度属于正常现象,保持良好通风,并疏散人员。
健康危害
在50%-60%的氧气环境中超过6小时可导致肺损伤,包括肺泡水肿、透明膜形成、低氧血症和进行性纤维化。吸入100%氧气24小时可引起肺水肿,此外还可能引起咳嗽、恶心、头晕、肺炎等疾病。长期存在于高浓度氧气环境下会导致肺部瘢痕形成。“液态氧气对皮肤和组织有刺激性,可能导致眼睛和皮肤冻伤。但氧气约占人体的65%,当人体氧气供应不足时,会导致有氧代谢和氧化磷酸化停止、细胞功能障碍和死亡,缺氧数分钟即可导致脑细胞无可弥补的损失而死之。因此,缺氧也被认定为是一种可能危及生命的疾病。 防护措施
身体防护:穿长袖特殊工作服(与液氧接触不会被点燃),并将裤子遮挡在靴子或高帮鞋外,以排出溢出的液体;
手部防护:佩戴绝缘手套;
眼部防护:佩戴护目镜或面罩。
急救措施
吸入治疗:除肺炎外,其余病症在氧压降低后迅速恢复。将受伤者转移到新鲜空气中处,根据受伤者的呼吸状况,进行人工呼吸或佩戴吸氧装置,并立即就医;
皮肤治疗:首先将受伤者身上被污染的衣服和鞋子脱下,用大量清水冲洗冻伤处,干燥后,使用无菌的敷料敷在皮肤烧伤处。应注意冻结在皮肤上的衣服在脱下前应先解冻,如果与液氧接触,用温水解冻,让受害者保持冷静和温暖,并立即就医。