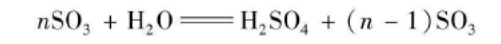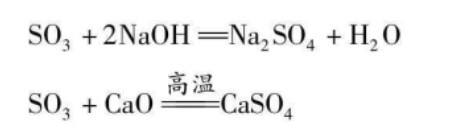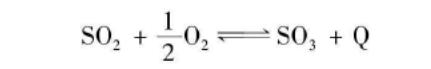三氧化硫
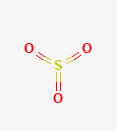
三氧化硫又称硫酸酐,是一种无色固体或油状液体,它是一种无机化合物,化学式SO3。三氧化硫有三种同素异形体,α-SO₃和β-SO₃常温下为固体,γ-SO₃常温下为油状液体。自然条件下,三氧化硫通常是三种同素异形体不同比例的混合体,熔点不固定,密度1.97g/cm³,易升华。三氧化硫溶于水生成硫酸,溶于浓硫酸生成发烟硫酸,与氯化氢反应生成氯磺酸。三氧化硫有强氧化性,能与水、氧气、氟、磷、四氟烯等剧烈反应。高温时SO₃的氧化性更为显著,它可氧化碘化钾、溴化氢以及铁、锌等金属。 基本信息
熔点
α-SO₃熔点为62.3℃;β-SO₃熔点为32.5℃;γ-SO₃熔点为16.8℃,自然条件下,通常是三种结构的混合体,熔点不固定
三氧化硫通常是由二氧化硫在催化剂存在下氧化得到的,在实验室中也可以通过加热发烟硫酸或焦硫酸来制取。三氧化硫可用于制造硫酸、氯磺酸、合成洗涤剂、阳离子交换树脂、染料及药物等,也可用作缩聚反应催化剂、磺化剂和氧化剂等。三氧化硫遇有机物容易引起火灾,暴露在空气中会产生有毒白雾,吸入或者吞咽有毒,接触会导致皮肤和眼睛灼伤。 分子结构
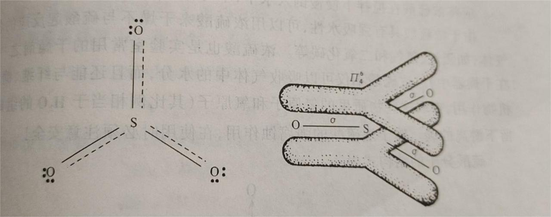
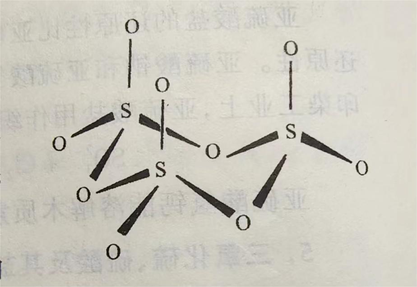
气态三氧化硫为单分子,其分子构型为平面三角形,硫原子以sp²杂化轨道与三个氧原子形成三个σ键,此外还以pd²杂化π轨道,与三个氧原子形成四中心六电子大π键。在这个大π键中,有三个电子来自硫原子,另三个电子分别来自三个氧原子。在SO₃分子中,键角为120°,键长为143pm,比S-O键(155pm)的键长短,故具有双键特性。其分子构型图所示。 SO₃固体存在α、β、γ三种同素异形体。其中α-SO₃的晶体与冰的结构相似,为SO₃的三聚分子;β-SO₃为石棉状针状晶体;γ-SO₃为正交系结晶或液体,是(SO₃)₃形成的环状结构,固态时硫原子采取sp³轨道杂化成SO4四面体,三个这样的四面体通过共用氧而成环。γ-SO₃的晶体结构见下图。液态SO₃主要是以三聚分子形式存在。 理化性质
物理性质
三氧化硫是一种无色固体或油状液体。三氧化硫有三种同素异形体,α-SO₃的晶体与冰的结构相似,熔点为62.3℃,在25℃下蒸汽压为9731Pa;β-SO₃常温下石棉状针状结晶,熔点为32.5℃,在25℃下蒸汽压为4.59×10⁴Pa;γ-SO₃常温下为油状液体,熔点为16.8℃,沸点为44.8℃,在25℃下蒸汽压为5.77×10Pa。自然条件下,三氧化硫通常是三种同素异形体不同比例的混合体,熔点不固定,密度1.97g/cm³,易升华。
化学性质
遇水成硫酸
三氧化硫极易与水反应产生硫酸,同时放出大量的热,反应方程式如下:
当式中的n=1时,得到无水硫酸;当n<1时,得到含水硫酸;当n>1时,得到发烟硫酸。
磺化反应
三氧化硫作为磺化剂,可直接加成到苯环上,没有水产生。例如用三氧化硫做磺化剂合成对甲苯磺酸,反应方程式如下: 三氧化硫参与的磺化反应有以下几个特点:1、三氧化硫磺化反应剧烈程度远于其他磺化剂;2、大多数有机物与三氧化硫的气相磺化反应都是瞬间完成,且大量放热,一般都将三氧化硫用惰性气体稀释以降低反应速度;3、磺化反应前后体系黏度变化很大,一般情况下产物黏度是原料黏度的15-300倍。4、局部高温或三氧化硫比例过大会发生副反应。
与氯化氢反应
三氧化硫可以和氯化氢直接反应生成氯磺酸。方程式如下:
其他反应
三氧化硫具有强氧化性,能与水、氧气、氟、磷、四氟烯等剧烈反应,磷与SO₃接触会燃烧生成P₄O₁₀。高温时SO₃的氧化性更为显著,他可氧化碘化钾、溴化氢以及铁、锌等金属。
制备方法
SO₂氧化
经过净化和干燥的二氧化硫气体和氧气在钒催化剂的作用下发生氧化反应生成三氧化硫。反应化学方程式见下图。这个工艺采用的钒催化剂,是以五氧化二钒为活性组分,以氧化钾为助催化剂,以硅藻土或硅胶为载体制成的。二氧化硫的起始浓度影响反应平衡和转化率,它的最佳浓度受生产二氧化硫的原料(硫磺、硫铁矿或含煤硫铁矿)的影响。这个反应在常压下转化率可达97.5%,温度一般控制在425-600℃之间。如果生产工艺采用一次吸收,最终转化率可达97.5%-98.0%,如果采用两次吸收,最终转化率可达到99.5%以上。 蒸馏焦硫酸或发烟硫酸
三氧化硫可以通过蒸馏发烟硫酸或焦硫酸来制备。该蒸馏系统由进料泵、蒸馏釜、蒸馏塔、冷凝器、接收计量槽和尾气吸收装置等组成。蒸馏釜温度控制在250℃左右,塔顶温度控制在45℃左右。可在接收计量槽中预先加入适量的稳定剂来防止三氧化硫聚合。稳定剂一般选择硼酸酐、二苯砜、硫酸二甲酯、甲基硅烷等。发烟硫酸经蒸馏后,其SO₃浓度下降,可配成98%的浓硫酸出售。故该方法不会造成资源浪费,也不会污染环境。在实验室条件下制备三氧化硫也是通过加热过硫酸或焦硫酸来实现的。 检测方法
槲皮素比色法
槲皮素比色法适用于空气中的三氧化硫的检测。其原理是在酸性乙醇溶液中钍盐和槲皮素会形成黄色的络合物,这种络合物遇到硫酸会生成无色络合物,使溶液黄色消退,根据其颜色变化来比色定量。该方法用硫酸钾配成硫酸的标准溶液,用皂素溶液做吸收液,用硝酸钍溶液和槲皮素的乙醇溶液做显色剂,用盐酸调PH值。检测时先让吸收液充分吸收空气中三氧化硫,然后和配置成不同浓度的标准液一起显色。充分显色后,在分光光度计上比色定量。 氯化钡比浊法
本方法适用于空气中雾态三氧化硫的检测。其原理是将空气中的三氧化硫用微孔滤膜采集,用氯化钡充分析出后,测量吸光度,进行定量。用硫酸钾配制硫酸标准溶液,用氯化钡和盐酸配氯化钡溶液。检测步骤是将吸收了空气的微孔滤膜浸出后,溶液用配好的氯化钡溶液显色,对照空白试剂和配制好的硫酸溶液,可根据吸光度定量分析。
重量法
本方法适用于水泥中三氧化硫成分的测定,其原理是在酸性溶液中用氯化钡沉淀硫酸盐,经过滤灼烧后称量,以三氧化硫的形式计测定结果。检测要点是:1、往干燥烧饼中加样品和水以后要快速搅拌,使样品完全分散,防止结块。2、准确量取盐酸,控制好酸度。这样可以使硫酸钡完全沉淀,消除共沉淀状态。3、滴加氯化钡溶液速度不要太快,防止生成可以透过滤纸的小颗粒沉淀。4、加入氯化钡溶液后应确保沉淀完全且沉淀颗粒较大。5、滤纸要灰化完全,防止硫酸钡反应成碳酸钡,影响检测结果。6、要严格控制灼烧温度,温度过高,硫酸钡分解。 应用领域
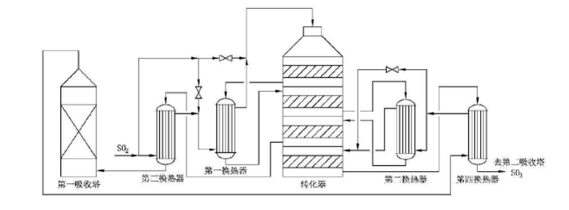
工业生产硫酸
工业生产硫酸,有硝化法和接触法两种。接触法在世界各国硫酸生产中占主要地位,其流程是先将硫磺或硫铁矿等原料氧化成二氧化硫,所得含二氧化硫的混合气体经过净化及干燥后,在钒催化剂作用下与氧气反应生产三氧化硫,然后进入吸收塔。经过四段两次转化两次吸收后可得成品硫酸或发烟硫酸。用的较多的四段转化流程是(2+2)和(3+1)流程。(2+2)流程是指炉气经过两段转化后进行中间吸收,然后再经过两段转化后进行第二次吸收。(3+1)是指炉气经过三段转化后进行中间吸收,然后再经过一段转化后进行最终吸收。虽然(2+2)流程转化率略高,但是(3+1)流程在换热方面较易配置,因此,中国目前多采用(3+1)流程。如下图所示:
氯磺酸原料
多数氯磺酸生产装置采用三氧化硫气体与氯化氢气体,在130-230℃下反应合成气态氯磺酸,再经冷凝、分离后得到液态氯磺酸。该方法缺点可概括为以下几点:1、尾气污染严重,处理费用高;2、设备体积庞大,结构复杂,腐蚀严重;3、能耗高。
在实验室条件下,还可以新蒸的40%发烟硫酸和氯化氢气体来制备氯磺酸。将发烟硫酸置于蒸馏瓶内,在低温条件下,将干燥的氯化氢气体通入瓶底,至不再吸收为止。将反应后的混合物蒸馏,收集149℃-151℃的馏分,收率95-98%。 合成洗涤剂
以十二烷基苯磺酸钠为例,它是由十二烷基苯经磺化和中和两步反应得到的。其磺化反应就是用三氧化硫做磺化剂。具体工艺是以十二烷基苯为原料,以三氧化硫为磺化剂,在槽式反应器中发生反应。反应温度为50-52℃,三氧化硫在空气中的体积分数为3%-5%,三氧化硫与十二烷基苯的摩尔比为1.15:1,反应时间为90分钟。 磺化反应磺化剂
三氧化硫作为磺化剂可广泛用于多种有机磺化反应,这些反应根据物料状态可分为三类:气态三氧化硫磺化法,液态三氧化硫磺化法,三氧化硫-溶剂磺化法和三氧化硫络合物定位磺化法。
气态三氧化硫磺化法优点是:不产生水;用量接近理论量;三废少,利于环保;反应速度快。因此该方法已在工业上被广泛采用。其缺点是三氧化硫过于活泼,放热量大,容易造成局部过热和氧化、焦化等现象。例如生产对甲苯磺酸就是用的气态三氧化硫法
液态三氧化硫发生磺化时反应剧烈,只适用于稳定的不活泼的芳香化合物的磺化,而且原料和产物在反应条件下粘稠度不能太高。该方法的优点是不产生废酸、后处理简单,产品收率高。缺点是非产品砜类的比例过高。该方法可用于硝基苯、对硝基甲苯和对硝基氯苯的生产。 三氧化硫-溶剂磺化法是将被磺化物或三氧化硫溶于溶剂中,再加入另一反应物。所用溶剂可以是无机溶剂,如硫酸,也可以是有机溶剂,如二氯乙烷、二氯甲烷、石油醚、硫酸二甲酯等。该方法可用于生产2-萘磺酸或1,5-二萘磺酸。 三氧化硫络合物定位磺化法是让三氧化硫与一些试剂络合后再进行磺化反应。这些络合物包括1,4-二氧杂烷、三甲胺、DMF、氟石、硅酸盐、硅胶、硅酸硼、粘土等。这些络合物的稳定性好于发烟硫酸,而反应活性反而更低,因此反应比较温和,选择性高副产物少,产品纯度好,适合小批量生产。例如用1,4-二氧杂烷与三氧化硫络合后与苯乙烯反应可得到β-苯乙烯磺酸。 此外三氧化硫还可用于缩聚反应催化剂、氧化剂以及生产阳离子交换树脂等。
安全事宜
危险性
三氧化硫遇水发生爆炸性剧烈反应。与氧气、氟、氧化铅、次亚氯酸、过氯酸、磷、四氟乙烯等接触会剧烈反应。对大多数金属有腐蚀性。三氧化硫有剧毒,吸入或吞咽会中毒。
毒理学资料
侵入途径:吸入或食入。
健康危害:三氧化硫有剧毒,吸入或吞咽会中毒。三氧化硫对皮肤和黏膜组织有强烈的刺激和腐蚀作用,与眼睛接触可引起结膜炎、水肿、角膜混浊甚至导致失明。吸入会引起呼吸道刺激症状,高浓度下会导致死亡。口服后会引起消化道灼伤及溃疡,严重者可能引起胃穿孔、喉痉挛、腹膜炎、肾损害等。 急救措施
皮肤接触 | 立即脱去被污染的衣物,用大量流动清水冲洗不少于15分钟,就医 |
眼睛接触 | 立即提起眼睑,用大量流动清水冲洗不少于15分钟,就医 |
吸入 | 迅速脱离现场至空气清新处;保持呼吸畅通,如呼吸困难可吸氧;如有严重者,可对其进行进行人工呼吸。就医 |
食入 | 用水漱口,饮用牛奶或蛋清。就医 |
存储
在三氧化硫处于稳定状态下存储。要存放于17-25℃,且干燥的环境中。应远离食品、饲料和其他不能共处的物品。
存储液态三氧化硫必须将环境温度保持在35-40℃之间,温度必须在摄氏40度以下,否则液态气化率升高。如果在运输过程中三氧化硫结晶固化,可将存储它的钢瓶用水浴或低压蒸汽加热,以及采用解冻室等方法解冻。然后将解冻后的钢瓶移入35-40℃的暖房降温后存放待用。
泄露处置
如发生三氧化硫泄露,应迅速撤离泄露污染区域人员至安全处,并立即隔离150米,严格限制出入。现场处置人员应穿戴好正压式呼吸器,穿戴防酸碱工作服,尽可能切断泄漏源。
液体泄露 | 用泵转移至槽车或专用收集器内,回收或运至废物处理场所 |
固体泄露 | 用洁净的铲子收集至合适的容器内 |
小量泄漏 | 用沙土、蛭石或其他材料吸收 |
大量泄漏 | 构筑围堤或挖坑收容 |
消防措施
三氧化硫遇水发生爆炸性剧烈反应。与氧气、氟、氧化铅、次亚氯酸、过氯酸、磷、四氟乙烯等接触会剧烈反应。三氧化硫接触有机材料会引起火灾。对大多数金属有腐蚀性。 消防人员必须佩戴过滤式防毒面具或隔离式呼吸器,穿全身防火防毒服,在上风处灭火。灭火时尽量切断泄漏源,然后根据着火原因选择适当灭火剂(如干沙、二氧化碳等)。禁止用水和泡沫灭火。