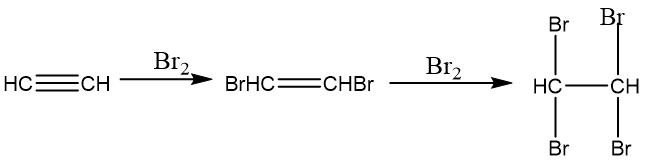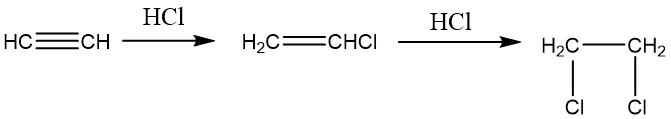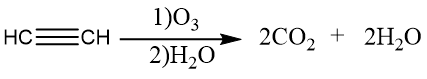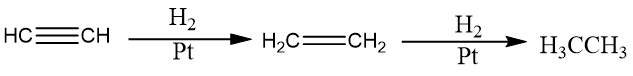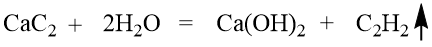乙炔
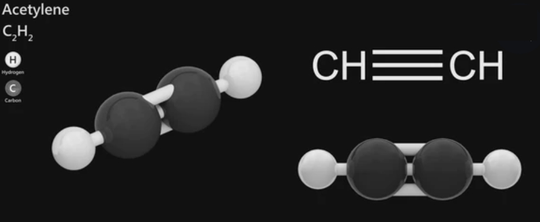
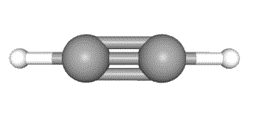
乙炔-结构式
乙炔,一种有机化合物,是最简单的炔烃。英文名:acetylene,俗称电石气。化学式为C₂H₂,分子量为26.04。在常温常压下,纯的乙炔为无色无味的气体,工业制备的乙炔具有刺激性臭味。微溶于水,可溶于丙酮、乙醚等有机溶剂。乙炔官能团为碳碳三键,能与水、卤素等发生加成反应,也能在不同条件下发生聚合反应,可以通过特色反应定性定量地鉴别乙炔。乙炔本身并没有毒性,但在高浓度时会造成窒息,与液态乙炔直接接触会造成冻伤。 基本信息
性质
危险性
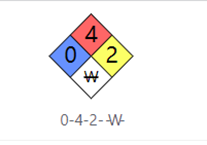
NFPA 704
0-暴露在火中时对人体造成的危害不超过一般可燃物。
4-在大气压和常温下快速蒸发或容易在空气中扩散并容易燃烧的材料。
2-在高温高压下容易发生剧烈化学变化的材料。
w-无水:与水发生剧烈反应或爆炸的材料。
工业上普遍使用的乙炔制备方法是电石法,但是电石法能耗大、成本高,许多发达国家已逐步将廉价的天然气作为生产乙炔的原料。乙炔也是合成有机物最重要的原料之一,被广泛应用于纺织、临床、建筑、印刷、农业、冶金等领域。还有研究发现乙炔对环境保护也有一定的意义。
发现历史
乙炔被发现的非常早,1836年,爱尔兰港口城市科克(Cork)皇家学院化学教授戴维·爱德蒙德(Davy,Edmund)在制备金属钾的过程中,将残渣(碳化钾)倒入水中,产生了一种气体并发生爆炸,通过分析确定了这一气体的化学组成是C₂H(采用碳的原子量等于6计算)。
1859-1862年间,法国化学家贝特洛(Berthelot Pierre Engène Marcelin)通过各种方法制得乙炔,测定它的化学组成是C₁H₂,并命名为acetylene。 1867年德国有机化学家埃论迈尔(Erlenmeyer,Richard August Carl Emil)确定了乙炔的分子式,并指出其中存在碳碳三键。
化学架构
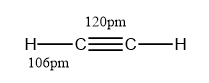
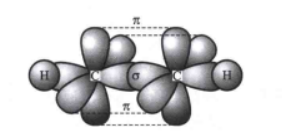
乙炔分子是直线形结构,碳碳三键的键长为120pm,碳氢键的键长为106pm,碳碳三键与碳氢键的夹角为180°。分子中的两个碳原子都采用sp杂化,彼此各用一个sp杂化轨道沿键轴方向重叠形成碳碳σ键,每个碳原子的另一个sp杂化轨道分别与一个氢原子的1s轨道重叠形成碳氢σ键,每个碳还有两个未参与杂化且互相垂直的p轨道,这些p轨道互相平行,侧面重叠,形成两个相互垂直的π键,两个π键的电子云呈圆柱状对称分布在碳碳σ键周围。而且其中π键由于键能低,很容易被打开。 理化性质
物理性质
纯乙炔在常温常压下为无色无味的气体,电石法制备的乙炔因含有硫化氢、磷化氢等副产物而带有类似大蒜的臭味。乙炔熔点-83.℃(-119°F,升华),沸点-83.9℃(-119°F,升华),密度1.165g/L(gas,0°C,1atm),自燃温度305℃,闪点-17.8℃(0°F),蒸气密度0.91g/cm³(比空气轻),空气中爆炸极限为2.5%-100%。在水中溶解度为1200mg/L(25℃),微溶于乙醇、乙酸、二硫化碳,溶于丙酮、苯,几乎混溶于乙醚。乙炔与水在特定的压力和温度下会生成水合晶体,这种晶体的存在可能会造成乙炔管道的堵塞。 化学性质
亲电加成反应
与卤素加成:乙炔与卤素的加成分布进行,先生成二卤代烃,再加成生成四卤代烃,有时需要加入催化剂,比如FeX₃或SnX₃。
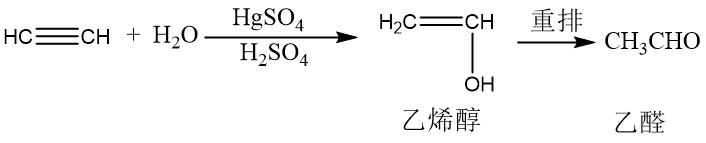
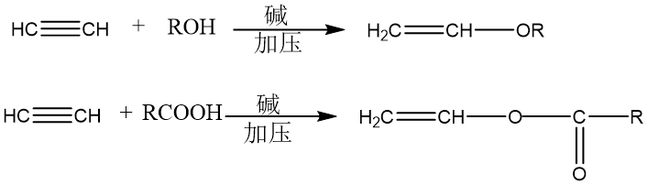
与水的加成:乙炔与水的加成通常需要硫酸和硫酸汞作催化剂,乙炔与一分子水加成生成一种不稳定化合物—烯醇,烯醇不稳定,重排转变为相应的酮式,这种重排叫做烯醇式-醛(酮)式互变异构。 亲核加成反应
乙炔与醇、酸的亲核加成反应可生成乙烯基醚和羧酸乙烯酯。
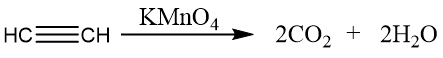
氧化反应
乙炔的氧化反应:
利用乙炔的氧化反应,可以定性检验碳碳三键的存在。
还原反应
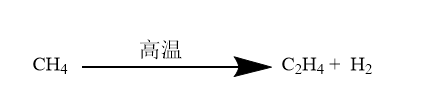
乙炔与氢气加成可以得到乙烯,进一步加成可以生成乙烷。根据催化剂的选取可以决定反应进行的程度,采用铂(Pt)、钯(Pd)、镍(Ni)等活性较高的催化剂并且氢气过量时,生成乙烷;若采用活性较低的催化剂(如Lindlar催化剂或P-2催化剂),可部分生成乙烯。 酸性
碳碳三键中的碳原子sp杂化,电负性较大,所以碳氢键的电子云主要位于碳原子周围,使氢原子带正电,易电离,使的乙炔具有酸性(比水弱)。
炔烃的特色反应
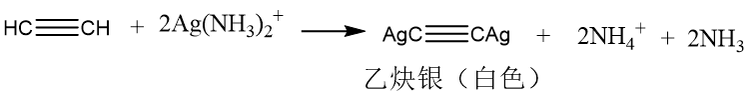
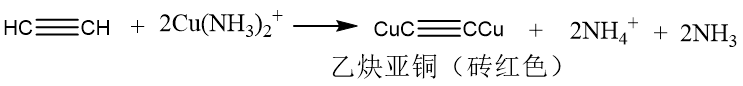
乙炔中的炔氢(直接连接在碳碳三键碳原子上的氢原子)可以被Ag⁺、Cu⁺等金属离子取代,生成不溶性炔化物。可以用来检测和鉴别乙炔。 以上金属炔化物干燥后受热或者受到撞击会发生剧烈爆炸,所以在反应结束后,应立即加入稀硝酸或盐酸使其分解。 聚合
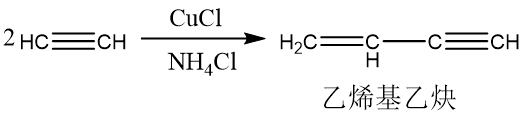
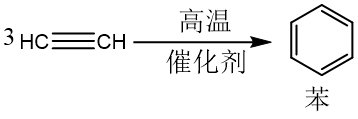
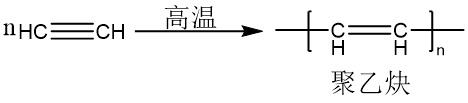
根据催化剂的不同,乙炔可以发生二聚、三聚、多聚反应。
制备方法
电石法
电石法是由电石(CaC₂)与水发生水解反应制得乙炔的方法,反应方程式为:
该方法原料易得,但污染严重,能耗高,制得的乙炔副产物较多。
天然气法
部分氧化法
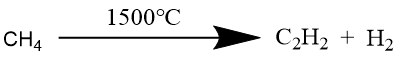
部分氧化法是将天然气和氧气混合原料预热至600~650℃,在氧化裂解炉中,1500℃时甲烷裂解产生乙炔,其主要化学反应方程式为: 这种方法污染小,产生的副产物(一氧化碳和氢气)可以利用做其他产物原料,且工业上基建投资少,可大规模生产,操作简单。
电弧法
电弧法是通过电弧炉中的电弧产生的高温使天然气或其他小分子烃裂解产生乙炔。这种方法原料可以使用任何气态烃,但与部分氧化法天然气燃烧产热相比,该方法产生的热量均由电弧产生,能耗大,成本高。 等离子体法
等离子体法是利用等离子体离解天然气制备乙炔的方法。这种方法工艺简单,成本低,安全可靠,无污染,是一种新的,先进的制备乙炔的方法。 应用领域
工业
乙炔在工业方面具有非常广泛的应用前景。乙炔燃烧时能放出大量热,可用于金属焊接和切割,当空气充足时,乙炔充分燃烧并发出明亮的光,可用于照明。由于碳碳三键的存在,乙炔可以用于沉淀金属,特别是铜、银。乙炔化学性质活泼,能与许多试剂发生加成反应,使许多有机物人工合成的重要原料之一。它被用于溶剂、涂料、增塑剂、胶粘剂、合成橡胶改良剂、香料、药物、除草剂的合成,在纺织、农药、临床、建筑、印刷、农业、冶金等领域有广泛的应用。 环境保护
还有研究发现乙炔对环境保护也有一定的作用,比如在生物柴油中添加乙炔,改善了生物柴油的不良性能与燃烧,可明显减少烟雾排放,降低了HC、CO、CO₂的排放量。还有空气中乙炔和氯的混合物在辐照下生成了臭氧,这是除了二氧化氮光解产生臭氧以外,发现的其他产生臭氧的机制之一。 安全事宜
毒理学数据
途径/生物体 | 剂量 | 影响 |
吸入/狗 | 致死浓度(50%):850000ppm | 全身麻痹,呼吸刺激 |
吸入/人体 | 最低毒性浓度:200000ppm/4M | 周围神经和感觉异常,呼吸困难 |
吸入/人体 | 最低致死浓度:50pph/5M | |
吸入/大鼠 | 最低毒性浓度:781111ppm/15M | 全身麻痹 |
吸入/大鼠 | 最低死亡浓度:900000ppm/2H | 全身麻痹,抑制呼吸 |
注:以上数据均来自
火灾危害
乙炔和空气混合时,容易产生爆炸。
灭火方式:灭火前尽可能阻止气体流动,不断喷水给暴露在火中的容器降温。从上风接近火灾,避免有毒物质挥发,建议使用干粉,二氧化碳灭火器。如果火势无法控制,可以考虑扩大范围。 健康危害
当乙炔与40%或更多比例的氧气混合时,它可作为一种麻醉剂,吸入后可能会出现头痛,头晕和意识丧失等症状,如果乙炔含量过高,可能会窒息死亡。若皮肤或眼睛接触到乙炔(液体),会造成冻伤,需及时用大量清水冲洗。
防治措施
眼睛接触后,如果眼组织冻结,请立即就医,如果组织没有冻结,立即用大量清水冲洗眼睛至少15分钟,并且频繁眨动眼睛,如果眼睛出现疼痛、肿胀、畏光等不适,请尽快就医。
皮肤接触后,如果出现冻伤,请立即就医,为防止进一步受伤,请不要冲洗或用毛巾擦拭,也不要试图用力脱下冻伤部位的衣服,如果没有冻伤,可以用肥皂和水清洗接触部位皮肤。
如果有人不慎吸入大量乙炔,请快速转移到空气新鲜的地方并拨打急救电话。
应急措施
乙炔发生泄露时,保持通风,将气体浓度保持在爆炸混合物的范围以下并清除所有火源,快速移动至离源头至少800米处;如果发生火灾,应快速移动至离着火点至少1600米处,确保自己安全后,拨打救援电话。
储存和运输
储存
储存于阴凉、干燥、通风良好的地方。保持容器密封,远离所有的火源和氧化性材料,气瓶应直立存放,并牢固固定,防止跌落或被撞倒。可以通过擦拭肥皂水检测乙炔是否泄露以及泄露的准确位置。
运输
乙炔不能在加压液化后贮存或运输,必须把乙炔在10-12个标准大气压下压入装有丙酮饱和的多孔性物质的特制钢瓶中。装运时,应妥善固定乙炔气瓶位置,轻装轻卸,严禁抛,滑,滚,碰。运输过程应该严禁烟火,夏季运输要防止太阳暴晒,禁止与氧气及易燃物品同车运输。运输过程中执行交通、消防等部门的有关规定。