磷化氢 磷化氢结构式
磷化氢,又称膦,英文名Phosphine,化学式为PH₃,无机物,是一种无色易燃易爆气体,纯净的磷化氢没有气味,含有杂质的磷化氢具有大蒜或腐烂鱼的气味,25 ℃时密度为1.390 kg/m³,1 atm时沸点为-87.75 ℃,熔点为-133.8 ℃,不溶于热水,微溶于冷水,17 ℃时在水中溶解度为26 ml/100 ml,易溶于 乙醇 、 乙醚 和 氯化亚铜 溶液,具有强还原性。磷化氢有剧毒。磷化氢用于半导体和塑料工业、阻燃剂的生产以及储存谷物中的杀虫剂。
基本信息
性质
密度
1.53 kg/m³(0 ℃)
1.390 kg/m³(25 ℃)
溶解性
微溶于冷水,不溶于热水;
易溶于乙醇、乙醚和氯化亚铜溶液
水中溶解度:
26 ml/100ml(17 °C)
危险性
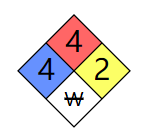
NFPA 7 04
健康危害等级:4-(在紧急情况下可能致命)
可燃等级:4-(在大气压和正常环境温度下迅速或完全蒸发或容易分散在空气中并容易燃烧)
稳定性等级:2-(在高温和高压下容易发生剧烈化学变化)
W :与水发生剧烈或爆炸反应
发现历史 磷化氢是大气中磷循环的中间产物,由Philippe Gengembre发现 。1680-1682年,爱尔兰物理学家、化学家 罗伯特·波义耳 (Robert Boyle)发现磷与碱一起加热能制得一种气体——磷化氢,并且磷化氢接触空气后会产生白烟 。1789年Lavoisier将磷化氢描述为磷的二元化合物和氢气的反应产物 ,1923年,研究认为厌氧菌可以将磷酸盐还原为磷化氢气体,但由于自然环境中磷化氢的含量很少,受采样与检测技术的局限,长期以来研究者
分布情况 磷化氢气体是在含有有机物的磷酸盐的降解过程中产生的,存在于许多环境场所,如海洋沉积物、 垃圾填埋场 、粪便、沼气池中 。人们所说“鬼火” 这一自然现象是磷的氢化物(主要是PH₃)在空气中燃烧发出的现象。自然界中的PH₃是动物尸体腐烂产生的,动物体内一般含有为体重1%的磷,这些磷以化合态存在于动物的骨头、牙齿、脑及血液中,动物死亡后,体内所含的磷的化合物在细菌的作用下缓慢地分解生成磷的氢化物PH₃,遇到空气发生自燃,随空气浮动 。 另一方面,土壤对磷化氢有基体吸附作用,是重要的磷化氢库,磷化氢作为土壤厌氧微生物代谢过程的中间产物,随后也可被氧化成磷酸盐并被植物吸收 ,生物活动如粪肥处理可以加速磷化氢的释放,所以磷化氢在地球上是与生有关的气体,被认为是潜在的生物信号,可以作为其他行星 2020年 在工业中,黄磷的制备过程、 磷酸钙 水泥和矿砂与水的反应都会产生磷化氢。除此之外,工业 镁粉 和 乙炔 气体的制备也会产生磷化氢。在农业中,饲料发酵与熏蒸剂( 磷化铝 、磷化镁、 磷化钙 、磷化锌)的遇水降解过程均会生成磷化氢,稻田排放也是磷化氢的重要来源。生成的磷化氢通过各种废物流释放到环境中。 若释放到大气中,磷化氢作为大气磷循环的中间成分,会与 羟基自由基 反应,从而降解;大气中磷化氢浓度在早晨最高,在白天经过氧化作用逐渐减少,这是因为太阳UV辐射会将磷化氢转化为磷酸盐,故日光强度越大,磷化氢含量越少。春季和冬季空气中的磷化氢水平较低。
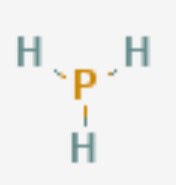
化学结构 磷化氢分子中心原子为一个磷原子,通过共价键与三个 氢原子 相连接,整个分子空间构型为三角锥形。
理化性质
物理性质 磷化氢,又称膦,化学式为PH₃,在环境温度下是一种无色易燃易爆气体,纯净的磷化氢没有气味,含有杂质的磷化氢具有大蒜或腐烂鱼的气味,25 ℃时密度为1.390 kg/m³,1 atm时沸点为-87.75 ℃,熔点为-133.8 ℃,不溶于热水,微溶于冷水,17 ℃时在水中溶解度为26 ml/100 ml,易溶于乙醇、乙醚和氯化亚铜溶液,可被活性炭吸附。
化学性质 磷化氢受热可分解为磷单质和氢气,具有强还原性,易被氧化;易自燃和爆炸。
磷化氢的燃爆反应分为链增长阶段、分支阶段、终止阶段和次级反应阶段,反应中生成PH₂自由基与OH自由基,可使 燃烧反应 不断地进行下去。磷化氢在潮湿空气中完全燃烧会出现火光或烟雾,若不完全燃烧,会出现蓝色或绿色火焰。 反应方程式如下:
制备方法
化学法 化学法主要有热解法、酸法、碱法、水解法。
热解法 此法利用 偏磷酸 晶体加热分解产生磷化氢气体,用冷阱收集粗制磷化氢。 热解法的优点是可以制备高纯度的磷化氢气体。
酸法 在酸的催化作用下将黄磷部分转化为 红磷 ,红磷与水蒸气加热,发生 歧化反应 ,生成磷化氢气体,残留的黄磷可以分离出去循环利用。该方法具有回收率高的特点,但生产步骤繁琐且成本较高。
碱法 由白磷和碱金属的氢氧化物水溶液(如 氢氧化钠 水溶液、 熟石灰 )制备,在碱性条件下使磷发生歧化反应 。该方法的利用率很低,且副反应会产生氢气,存在安全隐患。
水解法 该方法通过金属磷化物(如磷化钙、磷化铝、 磷化锌 、 磷化镁 )的水解(与空气中的水蒸气反应)获得磷化氢 。 磷化铁 的厌氧腐蚀也会生成磷化氢。 此反应为放热反应,导致生成的磷化氢有自燃危险,可以在反应物中加入稳定剂以控制反应速率,或者优化装置,使磷化氢在低浓度下生成。 Degesch公司采用改性Mg₃P₂生产磷化氢,使用一种特殊反应装置,Mg₃P₂粒子在二氧化碳气体的保护下水解,反应过程中使水不断循环,将反应放出的热量带走,有效降低制备过程的危险性。
电解法 采用铂电极(阳极)与铅电极(阴极)制成 电解池 , 电解液 为质量分数60%的磷酸溶液,在阴极溶液外循环过程中增加熔融态P₄,并控制电解液中P4的质量分数为1%,电解反应式如下: 电解法具有反应速率和生成物浓度可控的优点。
微波法 利用微波辐射法生成磷化氢,该法可以及时测定生成物磷化氢的浓度,以控制磷化氢以恒定速率产生,磷化氢回收率较高。主要方法为利用泵将质量分数为50%的 次磷酸 (H₃PO₂)或 亚磷酸 (H₃PO₃)水溶液加入反应器,控制反应温度为240 ℃,在微波辐射下与反应管尾部的 硅油 或磷酸反应,生成磷化氢,反应式如下:
检测方法
气相色谱法 可用便携式气相色谱法测定空气中的磷化氢或测量纯磷化氢气体中氢气、氧气等其他气体的含量,进而表征磷化氢气体的纯度 。具体操作方式为,先将标准物质和纯PH₃气体进样,采用 氮磷检测器 等多次测量,以峰面积的平均值计算杂质含量并对不确定度进行评价。气相色谱法存在仪器昂贵、灵敏度低的缺点,但步骤简单、分析迅速。
钼酸铵分光光度法 此种方法操作复杂,同时受多种外界条件干扰,酸度难以精确控制,由于显色时间不稳定,待测样品无法存放,要尽量避免隔天检测。
检测时,利用氧化剂采集待测气体,之后用分光光度计测量吸光度,测量后绘制吸光度-磷含量曲线,从而求得试样中的磷含量。
离子色谱法 用吸收管吸收待测样品,采样过程要迅速,在比色管中加入吸收管中液体,配制不同浓度梯度标准液,向各浓度标准溶液中加入 盐酸羟胺 直至溶液的颜色褪为无色,混合均匀后过滤,设定 离子色谱仪 的测量条件,根据峰面积测定磷化氢浓度。该方法准确性较高,且样品可以在室温下存放三天,比钼酸铵分光光度法更加具有实际应用价值。 电感耦合等离子体原子发射光谱法 通过电感耦合等离子体原子发射光谱法(ICP-AES)测定磷化氢,步骤简单,耗时更少,但仪器昂贵、操作难度较大。
除上述常用方法外,还可使用激光光谱分析仪检测磷化氢浓度,分析氮中磷化氢气体的均一性和稳定性,分析仪基于激光吸收光谱(LAS)。 还可使用紫外-可见光谱仪分析检测磷化氢,基质为空气。
环境影响 磷化氢既是一种有毒的污染气体,又是一种活泼的、强还原性的气体, 它与其他温室气体(如 甲烷 )竞争消耗羟基自由基,具有间接的温室效应。各种自然源与人为源产生并排放了大量的磷化氢,使其成为地球大气中普遍存在的痕量气体,并且影响了自然界中磷的生物地球化学循环与大气化学过程。
净化方法 工业黄磷、乙炔、电石的生产、镁粉的制造,半导体行业以及熏蒸剂的使用均会伴有磷化氢气体的产生,不仅造成环境污染,还会影响生产安全及企业效益,因此,需要采用合理的方法净化处理磷化氢废气,以提高生产效率、防治废气污染。主要废气处理法包括吸附法、燃烧法及化学氧化法,在工业中根据不同磷化氢浓度及工业要求采取不同净化方法。
吸附法 采用浸渍活性炭吸附磷化氢是较为常用的吸附方法,用HCl浸渍改性 活性炭 ,可以显着提高吸附净化能力;还 可以采用低温吸附法,在低温下用金属氧化物(如 氧化铜 、 氧化锰 )吸附磷化氢;还可以采用金属氧化物吸附法,将磷化氢加热分解为磷单质,与 氧化钙 反应生成磷化钙,从而吸附磷化氢。
燃烧法 燃烧法是在燃烧条件下去除磷化氢,这种方法去除磷化氢的效率很高,并且可以有效利用磷资源,但也存在设备成本高、经济效益低、能源浪费、磷酸烟雾会排入大气的缺点。
化学氧化法 鉴于磷化氢的强还原性,常采用氧化剂(如 浓硫酸 、 高锰酸钾 、 次氯酸钠 、 过氧化氢 )氧化磷化氢气体。次氯酸钠可将磷化氢氧化为 次磷酸钠 ,此法可作为生产次磷酸钠产品的工业方法;此外,浓硫酸也是常见的氧化剂,可将磷化氢氧化为磷酸,自身被还原为二氧化硫,同时生成水,不断稀释氧化剂,需要注意的是,在反应过程中须及时更换浓硫酸溶液以保证去除效果。采用浓硫酸进行化学氧化的效果较好,但同时会造成设备腐蚀的问题,反应过程中生成的二次废物二氧化硫也会对空气造成污染,带来二次处理问题。
应用领域
电子工业 磷化氢是一种重要的 电子特气 ,在离子注入和化学气相沉积(CVD)中用作磷源,主要用于外延硅半导体的n型掺杂剂。磷元素在 金刚石 中的施主能级远远低于氮元素在金刚 发光二极管 中的磷砷化镓膜。
熏蒸工业 磷化氢是一种熏蒸剂 ,粮食、烟草储存过程中需要进行害虫防治,可使用熏蒸剂对害虫进行消杀,磷化氢熏蒸是中国粮食储存杀虫应用最为广泛的方法,用于熏蒸剂的磷化氢年均消耗量大约为三百吨。磷化氢作为熏蒸剂具有挥发快的特点,不会损伤谷物,且操作简单、经济易得,一般使用磷化铝药剂吸收空气中的水分生成磷化氢气体,对虫害有一定抑制作用,反应式如下:
此反应为放热反应,对于磷化氢这种可燃气体来说具有安全隐患,故在作为熏蒸剂使用时需要添加 氨基甲酸铵 等阻燃剂防止磷化氢自然,以提升安全系数。
制备阻燃剂 磷化氢还是制备多种阻燃剂的原料 。工业上采用磷化氢、 甲醛 、 盐酸 在催化剂作用下生产阻燃剂,反应式如下:
安全事宜
消防相关 纯净的磷化氢气体属于可燃气体,在潮湿的空气中可能会发生自燃,自燃温度约为38℃,在压力较高的环境中接触明火或受热可能有爆炸风险,爆炸产生的水蒸气密度较大,会向地面扩散,与火源再次接触使爆炸加剧。
在储存与应用磷化氢时需要注意通风,以使磷化氢浓度均匀分布并始终处于燃爆极限以下;还可以采用降低氧含量的方法,在磷化氢的空气混合物中加入惰性气体,惰性气体的相对含量上升而氧气含量下降 在燃爆事故发生后,应第一时间进行处理,防止火势进一步蔓延,将损害降到最低 。可以采取的措施有:泄爆,即在爆炸发生的初始阶段将密闭空间的压力释向外部,使空间内部不受爆压;抑爆,在起火的初始阶段通过喷淋抑爆剂或灭火剂控制火势,这种方法较为简单,广泛应用于磷化氢防爆工作中,通常使用的抑爆剂为磷酸二氢盐干粉抑爆剂。
健康相关 磷化氢具有剧毒性,大鼠吸入LC₅₀为17 mg/m³(4 h) ,成年人在磷化氢浓度为0.05 mg/m³的环境中暴露半小时以上会有生命危险 。 吸入磷化氢气体对呼吸道伤害较大,会对肺部及中枢神经系统造成不良影响,还会导致肝、肾、心等脏器的损害;人体直接接触液态磷化氢可能会冻伤,过度接触可能导致 上吐下泻 、肌肉酸痛、呼吸困难甚至晕厥。 《工作场所有害因素职业接触限值》中明确规定磷化氢的最高允许浓度为0.3 mg/m³ ,为控制杀虫期间环境中磷化氢浓度在规定范围内,应进行实时浓度监控,并使用磷化氢净化器,在散气前对其进行净化处理。
急救事宜 由于磷化氢有剧毒性,故在制备和应用过程中应谨慎处理,防止泄露;操作人员应穿戴防毒面具,采用相应滤毒罐,避免接触皮肤和眼睛,避免吸入蒸气或雾气,相关实验完成后注意排空气体、及时洗手。
若发生磷化氢急性中毒事件,立即将患者转移至空旷地带,远离磷化氢聚集环境,保持其呼吸畅通;若是因摄入过量含磷盐导致中毒,应立即服用1%的CuSO₄溶液予以催吐,用活性炭进行吸附后用硫酸镁导泻。对患者进行生命体征检测以观测其病情状态,及早予以相应治疗。