氧化亚铜
氧化亚铜(Copper (I) oxide),化学式为Cu2O,是一种黄色至红色粉末的氧化物,熔点为1232℃,1800℃时分解成金属铜,并放出氧气。不溶于水,几乎不溶于有机溶剂;溶于稀矿物酸、氨及其盐类溶液。在干燥空气中稳定,在湿空气中会逐渐氧化成黑色氧化铜。易被氢、一氧化碳等还原成金属铜,红热时也能被对氧亲和力强的元素(如Al、Zn、Fe)还原成铜。氧化亚铜可由电解法、干法和葡萄糖还原法等制得。氧化亚铜可用于作物的杀菌剂,陶瓷着色剂和玻璃染色剂,在电器工业和船舶工业方面均有广泛应用。 基本信息
性质
溶解性
不溶于水,几乎不溶于有机溶剂;溶于稀矿物酸、氨及其盐类溶液。
危险性
物质结构
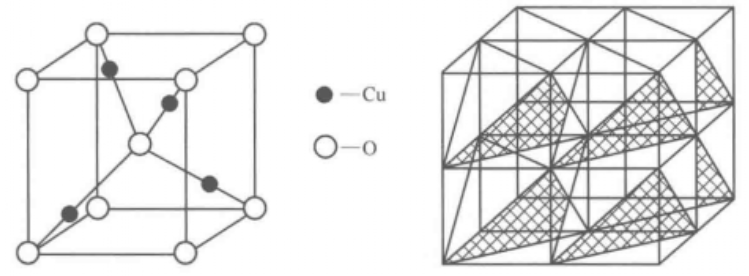
Cu2O的晶体结构为赤铜矿型,属等轴晶系,晶体结构如图所示。晶体中存在两种配位体,一种是[Cu-O2]的哑铃状,另一种是[O-Cu4]的四面体,四面体的四个顶角与氧相联结,构成一个具有立方结构的络阴离子[ Cu4O5],该立方体则相当于一个晶胞。自然界中的Cu2O晶体完整晶形极为少见,大多呈致密块状和粒状,偶尔可以见到有立方体a{100},八面体o{111}和立方体、菱形十二面体d{110}所组成的聚形。在水热条件下,Cu2O的结晶形态呈立方体、八面体、立方体和菱形组成的十二面体和五角十二面体p{021}所组成的聚形。 理化性质
物理性质
氧化亚铜外观为黄色至红色粉末,熔点为1232℃,1800℃时分解成金属铜,并放出氧气。不溶于水,几乎不溶于有机溶剂;溶于稀矿物酸、氨及其盐类溶液。
氧化亚铜是一种p型半导体材料,禁带宽度仅约2. 2eV,吸收波长为563nm的光子即可被激发,在可见光波段( 390-780nm)范围内,因此在太阳光的照射下即可引发光催化反应,是一种极具潜力的光催化剂。 化学性质
氧化亚铜热稳定性强,在加热到1800℃时才会发生分解反应,脱去氧气。
氧化亚铜在干燥空气中稳定,在湿空气中易被氧化成黑色氧化铜。 氧化亚铜能存在于强酸环境中,生成亚铜离子,在弱酸性及其他溶液状态中则将歧化成金属铜和铜离子。 Cu2O + 2Fe + 2H2Fe + 2Cu +H2O 氧化亚铜与氨水或氢卤酸等形成无色的络离子[Cu(NH3)2](遇空气即氧化成深蓝色的四氨合铜配离子[Cu(NH3)4])和[CuX2]。 Cu2O + 4NH3 + H2O2[Cu(NH3)2] + 2OH Cu2O + 2H + 4X2[CuX2] + H2O 氧化亚铜易被氢、一氧化碳、碳氢化合物等还原成金属铜,红热时也能被对氧亲和力强的元素(如Al、Zn、Fe)还原成铜。 制备方法
电解法
用铜的阴极和阳极电解食盐溶液可制得氧化亚铜。在阴极上析出氢,生成OH离子,阳极上的铜溶解生成Cu。
干法
将沉淀铜粉在干燥筒内烘干,粉碎,然后和氧化铜混合送入煅烧炉内加热到800~900℃进行煅烧,得到氧化亚铜。
湿法
葡萄糖还原法
葡萄糖还原法将硫酸铜溶液与葡萄糖混合后加入氢氧化钠溶液进行反应,生成氧化亚铜,经过滤、漂洗、烘干粉碎制得氧化亚铜产品。 CuSO4 + 2NaOHNa2SO4 + Cu(OH)2 2Cu(OH)2 + CH2OH(CHOH)4CHOCu2O+2H2O+CH2OH(CHOH)4COOH 亚硫酸钠还原法
硫酸铜(或氯化铜)被亚硫酸钠还原而制得氧化亚铜。化学反应式为:
2CuSO4 + 3Na2SO3Cu2O + 3Na2SO4 + 2SO2 铜粉焙烧法
氧化亚铜可由铜粉在空气中焙烧而制得。
水合肼还原法
以水合肼为还原剂,在醋酸铜溶液中制备氧化亚铜溶胶。 4Cu(OOCH3)2 + N2H2 + 2H2OCu2O + N2 + 8CH3COOH 雕白粉还原法
雕白粉(甲醛化二水次硫酸钠)是亚硫酸氢钠与甲醛的加成物。在硫酸铜溶液中,333~363K温度条件下,于1h内向硫酸铜溶液中加人雕白粉溶液得到沉淀,过滤,热水洗涤除去硫酸根,干燥即得氧化亚铜。 H2CO·NaHSO3·2H2O + 2CuSO4 + 5NaOHCu2O + 3Na2SO4 + 5H2O + HCOH 羟胺还原法
将硫酸铜、硫酸胺、苟性钠按一定的比例混合制成溶液,再加入明胶溶液,搅拌反应离心分离。用水、乙醚洗涤,真空干燥,所得Cu2O为黄色-棕黄色。 (NH2OH)2·H2SO4 + 4(CuSO4·5H2O)+ 10NaOH2Cu2O + N2O + 5Na2SO4 + 29H2O 应用
农业
氧化亚铜被加工成细微颗粒,易形成保护膜,耐雨水冲刷,释放出来的铜离子与病原体作用,可有效抑制菌丝体的生长,破坏其生殖器官,起到杀菌作用。用于种子处理和叶面喷雾,拌种防治白粉病、叶斑病、枯萎病及腐烂病。
船舶防污涂料
工业氧化亚铜产品90%以上都用于船舶防污涂料。在涂料工业上用作防污涂料的防污剂,是通过海水对涂料和部分基料的溶解作用来实现防污的。铜离子在漆膜表面形成有毒溶液的薄层,可降低生物机体中主酶对生物生命代谢的活化作用,以此缩短生物寿命,并可使生物体内蛋白质凝固,从而达到防污的目的。氧化亚铜和海水作用如下:
Cu2O + 2H + 2Cl2CuCl2 + H2O 光催化
氧化亚铜是一种p型半导体材料,在太阳光的照射下可引发光催化反应,是一种极具潜力的光催化剂。氧化亚铜可以改变聚氯乙烯的热解途径,协同降低聚氯乙烯碳骨架的热裂解速度和促进成炭量的增加,并使挥发物的生成量减少,从而实现对聚氯乙烯的阻燃和抑烟作用。氧化亚铜还可以光催化分解水,从水中提取氢气。 太阳能电池
氧化亚铜是一种天然的p型半导体材料, 在氧化亚铜内部存在着大量的VCu, 这也是氧化亚铜能够进行p型导电的主要原因。为了增强太阳能电池的光转换效率, 相关领域的研究者又使用Ca掺杂Zn O、Sn掺杂In2O3薄膜作为太阳能电池的n型层。在进行太阳能电池研究与制作的过程中, 加强氧化亚铜薄膜的质量是提高太阳能电池性能的主要因素, 提高氧化亚铜的晶粒尺寸、降低氧化亚铜薄膜的电阻, 增强载流子的迁移率等都能够起到提升氧化亚铜薄膜质量的作用。 其他
以氧化亚铜为基,添加具有良好导电性的金属铜而构成的氧化物——金属复合材料,可以用来制备熔盐电解工艺过程中使用的非燃烧阳极。还可用作陶瓷和搪瓷的着色剂、红色玻璃染色剂,还用于制造各种铜盐和分析试剂及电器工业中的整流电镀。氧化亚铜是斐林测试和本氏测试还原糖的基础,含有醛基或酮基的单糖和多糖的水解产物,在碱性条件下煮沸能使斐林试剂中的二价铜离子还原为一价的氧化亚铜,而使蓝色的斐林试剂脱色。 安全事宜
毒性
大鼠极性经口LD50 1400mg/kg,急性经皮LD50>4000mg/kg。对兔皮肤和眼睛有轻微刺激,大鼠亚慢性经口LD50 500mg/kg,ADI 2mg/kg/d。 健康危害
氧化亚铜可通过吸入和食入吸收到体内。
短期接触:该物质刺激眼睛和呼吸道。吸入烟雾可能导致金属烟雾热。摄入可能会对肾脏和肝脏造成影响。效果可能会延迟。
长期接触:反复或长期接触皮肤可能引起皮炎。
储存与运输
本品为剧毒物,应贮存于干燥通风良好的库房内,不得与氧化剂混放。容器必须密封,防止与空气接触变成氧化铜而降低使用价值。不可与强酸、强碱及食用物品共贮混运。
应急处理
氧化亚铜不可燃,周围环境着火时,允许使用各种灭火剂。
发生泄露时,如果条件允许,先润湿以防止起尘。将泄漏物扫入有盖容器中。小心地收集剩余物。然后根据当地法规进行储存和处置。
急救措施
吸入:将患者移至空气新鲜处,休息,并及时就医。
食入:及时漱口,大量饮水,并及时就医。
眼睛:先用大量水冲洗几分钟(如可能易行,摘除隐形眼镜),然后就医。
皮肤:脱去污染的衣服,冲洗,然后用水和肥皂洗皮肤。并及时就医。