铜
铜矿石
铜(英文:Copper)是一种化学元素,元素符号Cu,原子序数为29,位于元素周期表中第四周期IB族,是一个重要的过渡金属元素。纯铜常温常压下是外观呈玫瑰红色、有光泽、有延展性、无气味的金属,表面氧化时呈紫红色,其密度为8.89 g/cm³(20 ℃),熔点为1083 ℃,具有优良的导电性、导热性、耐腐蚀性。延展性好,可进行各种冷、热加工。 铜在自然界中主要存在三种价态,分别是:Cu⁺、Cu²⁺和Cu³⁺。其中Cu⁺的化合物一般为白色或无色,固态铜的热稳定性较高,但在溶液中极其不稳定,易被氧化或还原,且其络合物溶解度较低。自然界中铜的主要存在形式是Cu²⁺,其在强氧化作用条件下可以稳定存在。Cu³⁺的化合物有较强氧化性,但稳定性较差。铜单质属于活性小的金属,常温下在干燥的空气中比较稳定,但若在潮湿的空气中,铜会与二氧化碳及水反应生成有毒的铜锈,即铜绿。铜在一定条件下能与氧气、酸、氨气、氰化物、硫化物等发生反应。 铜是有史以来最古老的金属之一,也是文明发展的重要材料之一。铜被广泛应用于电子、电气、交通、机械制造、国防工业等领域,在食品、农业等领域也有应用。
发现历史
经考古发现和研究证明,早在公元前六千年,安纳托利亚地区的人就开始使用铜了。金属冶炼技术从安纳托利亚向世界各地传播的时间大约在公元前两千年左右。在进入青铜时代前,人们使用过很长一段时间的红铜和坤铜合金。 大约公元前三千纪下半叶到前二千纪初,分布于南西伯利亚叶尼尼赛河中游米奴辛斯克盆地和阿尔泰地区的阿凡纳谢沃文化使用红铜打造耳环、手镯等饰品以及针、小刀等工具。公元前二千纪上半叶,叶尼塞河中游米奴辛斯克盆地盆地的奥库涅夫青铜文化,出土有较多的红铜以及青铜器,该文化可能源于阿凡纳谢沃文化。之后公元前两千纪至一千纪初,南西伯利亚出现了著名的安德罗诺沃文化,该文化的青铜制造技术较为成熟,出土了不少青铜锻造或铸造的武器、工具及其他日用品。在奥库涅夫文化尤其是安德罗诺沃文化时期,中国与南西伯利亚联系密切。中国进入青铜时代的时期大约在公元前两千纪左右。中国经夏商周三代到公元5世纪,发展出加入熟料和草灰控制制泥范性能的铸造技术,达到了青铜铸造技术的顶峰。 除青铜外,还有黄铜,中国仰韶文化(约公元前5000-3000年)晚期,已经从铜锌矿中制取铜锌合金即黄铜。公元前170年,罗马人利用碳酸锌矿石炼制黄铜。公元10世纪后,中国通过向炉甘石或氧化锌中加入铜制取黄铜。 到近现代,尤其是17世纪产业革命及法拉第电磁感应定律发现以来,铜和铜合金因具有优良导电、导热、耐蚀性能,被广泛应用于机械、电子、电器、化工等领域。铜以及铜合金的品种和消费量,已经成为衡量一个国家工业技术水平的标志之一。 分布情况
根据2016年美国资源调查局发布的统计数据,全球铜资源总量约有56亿吨,包括已探明资源21亿吨,待探测资源35亿吨。铜资源总储量的97%以上为斑岩型铜矿、砂页岩型铜矿、黄铁矿型铜矿、铜镍硫化物型铜矿。其中斑岩型铜矿约占铜资源总储量的55%,主要分布于美国智利、秘鲁、加拿大、伊朗、中国、巴基斯坦、蒙古、乌兹别克斯坦等国家;砂页岩型铜矿约占铜资源总储量的29%,主要分布于刚果、智利、俄罗斯、德国、波兰等国家;黄铁矿型铜矿约占铜资源总储量的9%,集中分布在中国、美国、俄罗斯、西班牙等国;铜镍硫化物型铜矿约占铜总储量的4%,该类型铜矿由多种贵金属共生、品位高,主要分布在西伯利亚和北美。 2016年美国资源调查局数据显示,全球铜矿储量(金属量)为7.2吨,其中北美地区占60%以上,亚洲和非洲各占约15%。全球铜储量最高的是智利,占全球铜储量的29.2%;澳大利亚占总储量12.4%;秘鲁占总储量11.3%;墨西哥占总储量的6.4%;美国占总储量的4.9%;俄罗斯占总储量的4.2%;中国占总储量的3.9%;刚果(金)和赞比亚各占总储量的2.8%。 理化性质
物理性质
纯铜是外观呈玫瑰红色、有光泽、有延展性、无气味的金属,表面氧化时呈紫红色,常温下为固体,其密度为8.89 g/cm³(20 ℃),熔点为1083 ℃,具有优良的导电性、导热性、耐腐蚀性。延展性好,可进行各种冷、热加工。液态的铜密度为7.81 g/cm³(1200 ℃),并且液态铜能够吸收H₂、O₂、SO₂、CO₂、CO等气体。 化学性质
与氧反应
铜在常温、干燥的空气中不发生变化,温度高于185 ℃时开始氧化,350 ℃以下生成红色的氧化亚铜,350-1500 ℃生成黑色氧化铜。 铜在潮湿的空气中会生成铜绿(CuCO₃·Cu(OH)₂)。
与酸反应
铜不与单独的盐酸、稀硫酸反应,能与硝酸、浓硫酸等氧化性的酸反应生成相应的铜盐和水。 与氨气、氨水反应
铜红热状态与氨气反应生成氮化物。
在碳酸盐参与的条件下,铜能与氨水反应生成配盐。
与氰化物反应
铜能与氰化物的水溶液反应生成二氰合铜酸钠和强碱,砷、锑、铋的氧化物作氧化剂会被还原为单质。 与硫化物反应
与氯化铁反应
铜与氯化铁的反应是无线电工业制印刷电路板的重要反应。
与二氧化氮反应
常温下铜能与二氧化氮反应。
化学结构
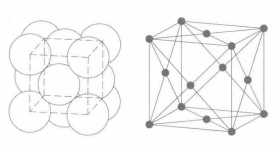
纯铜的晶体结构为面心立方晶格,铜原子成立方最紧密堆积。空间群为-,晶胞参数a₀=0.3608nm,原子配位数CN=12。 化合物
铜的化合物有许多,主要包括铜的氧化物(CuO、Cu₂O)、铜的氢氧化物[Cu(OH)₂]和铜盐[CuCl、CuSO₄·5H₂O、Cu(NO₃)₂]。下面介绍几类常见的铜的化合物和铜矿物。
氧化铜(CuO),一种碱性氧化物,不溶于水,但溶于酸,具有较好的热稳定性。大于1273 K时,可以被分解成Cu₂O和O₂。同时,在高温中也容易被H₂、C、NH₃等还原剂还原成铜。 CuSO₄·5H₂O常被称为蓝矾或胆矾,加热至250 ℃会失去结晶水变为白色的无水CuSO₄粉末。 氯化铜(CuCl)是最重要的亚铜盐,难溶于水,能溶于氨水、NaCl、KCl以及浓HCl溶液并生成对应配合物,在潮湿空气中会被氧化并由白色变绿色。CuCl是共价化合物,熔体导电性差,能吸收CO生成CuCl·CO。 同位素
铜是一种重要的过渡金属元素,有两种稳定同位素,分别是⁶³Cu和⁶⁵Cu,其含量分别为69.2%和30.8%。
有研究发现现代河流平均铜同位素含量约0.7%,现今海洋的平均铜同位素含量为0.7%~0.9%,根据质量守恒,自然界应该存在一个较轻的端元使得现在的远洋沉积物和静海沉积物能够稳定在0.3%。 生产方式
铜冶炼技术的发展经过了漫长的过程,现行的炼铜方法分为火法炼铜和湿法炼铜。其中,世界上80%以上的铜都采用火法炼铜技术生产。 火法炼铜
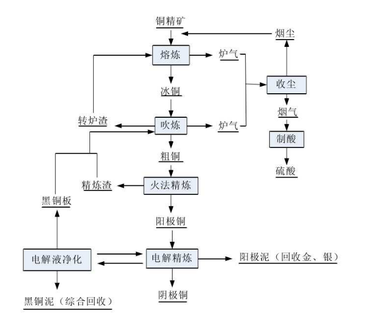
火法炼铜的原料主要是硫化铜精矿。首先熔炼铜精矿,这也是火法炼铜中最重要的冶炼过程,即在高温下氧化焙烧矿(矿物原料进行热化加工后的产物)所含的部分铁或铜精矿,并与脉石、熔剂等形成熔渣再将其除去,从而产出铜硫或粗铜。然后,为了将熔炼所产出的含铜50%的冰铜转变成含铜98%左右的粗铜,可以再将熔炼所得冰铜吹入转炉。最终粗铜精炼有高温精炼和电解精炼两种方法,图中使用的是火法精炼,可通过精炼吹炼得到的产品最终得到纯铜,同时还能回收金银等贵金属。火法炼铜流程如下图: 火法工艺具有能耗低、产率高、电铜质量好、利于回收稀有、贵重金属等优点。但在生产过程中,每生产1 t的铜将产出2-3 t铜渣,其中还含有Fe、Cu、Zn、Pb、Co、Ni等以及少量贵金属Au、Ag等,然而大多数铜渣都是露天堆放,若不合理利用,不仅会浪费资源还会占用土地,甚至污染土壤和地下水,进而将会危害人类的健康。因此,虽然火法炼铜产率较高,但也要注意余渣的回收利用。
湿法炼铜
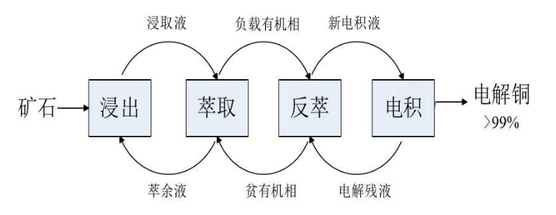
世界冶金史上第一个使用湿法炼铜工艺的国家是中国。“胆水炼铜”是中国古代流传下来的一种铜湿法冶金工艺。它不仅是现代铜湿法冶金的先驱,也是世界湿法冶金历史的开端。早在西汉时期(公元前206年-公元25年),淮南刘所著的《淮南万毕术》就记载了用苦胆水冶炼铜的过程:“白青得铁,即化为铜。”白青是指含有硫酸铜的水溶液。这句话的意思是,将铁器置于该溶液中,然后铁溶解,铜沉淀,这就是置换反应。这是中国最早的金属置换反应记载,也湿法炼铜的起源。 现代湿法炼铜工艺主要是从火法中难以利用的低品位矿石中回收铜,如氧化矿、难选硫化矿、剥离的表外矿、浮选尾矿以及废弃的矿山等。现代的铜湿法冶金流程主要分为L-SX-EW(浸出-萃取反萃取-电积)三部分,构成三个循环,如下图:第一步,先将铜矿石与酸反应,将铜转化为可溶性盐,然后进入溶液,完成浸出;第二步,将铜离子和萃取剂中的质子发生交换,再分别进入有机相和水溶液中,萃余液酸度将增加,然后再返回进行重新的萃取浸取,有机相中负载的电积残渣将被反萃取以获得富电解质,并且电解质的酸性将降低。萃取剂恢复至酸的形态,返回萃取;最后一步,通过电解,铜在阴极析出,其他产物则在阳极析出,最后浸出得到最终产品铜。 应用领域
工业领域
铜被广泛应用于电子、电气、交通、机械制造、国防工业等领域,其中在电气、电子工业中应用最广、用量最大。
电气工业
电气工业中,大量高导电性的铜被用来制作动力电机、开关、电缆、变压器、联接器等。电机的定子、转子和轴头等部件的制作都需要用到大量具有高导电、高强度的铜合金;大型电机如双水内冷或氢气冷却机绕组要使用水或氢气冷却,需要用到大长度的中空铜导线。
电子工业
铜在电子工业中的应用包括印刷电路、制作微电子和半导体集成电路等。铜印刷电路即将铜箔粘贴在支撑的塑料板上,使用照相的方法把电路布线图印制在铜板上;另外在电路的连接中也需要用到各种便宜、熔点低、流动性好的铜基钎焊材料;铜合金具有强度高、导电性和导热性好的优点,并且成本低,符合微电子器件引线框架的性能要求,是引线框架的重要材料。 交通工业
铜具有良好的耐海水腐蚀性能,铝青铜、锰青铜、炮铜、白铜、铝黄铜等铜合金已成为造船的标准材料,一般铜和铜合金能占军舰和商船自重的2-3%。汽车制造也需要用到铜和铜合金,主要应用于散热器、齿轮、轴承、制动系统管路、电力系统等,用铜量比较大的是散热器;铁路的电气化同样也需要大量的铜和铜合金,每公里的铁路架空导线就需要使用2吨以上的异型铜线。 食品领域
长期以来,铜也一直是改善人类生活条件的关键所在,是与人类关系非常密切的金属之一,也是可持续经济发展过程中必不可少的基础原材料。铜存在于一些食物中,如海鲜、坚果、种子、谷物、肉类等。铜也是一种天然存在于整个环境中的金属,比如岩石、土壤、水和空气。铜也是植物和动物(包括人类)中必不可少的元素,这意味着它是我们生存的必要条件。因此,植物和动物必须从进食,饮水和呼吸中吸收一些铜。
由于在潮湿空气中铜表面形成的铜绿薄膜有毒,所以不能直接用来作为餐具器皿,若要使用铜制器皿,表面必须镀锡。
农业领域
此外,铜化合物还会用于农业中,用于治疗霉菌等植物病害,或作为杀虫剂和除草剂,也用于水处理,并作为木材、皮革和织物的防腐剂。 其他应用
铜的耐蚀性能好,在化学工业、制糖、酿酒等行业可用于制作各种管道、阀门以及反应器;铜制备的某些化合物是电池、电镀、农药、催化剂、染料等行业的重要原料。
安全健康
铜对人体健康的好处
成人体内一般含铜70-100 mg。铜在人体所有的器官中均有分布,一般来说肝脏的含铜量最高,脑和心脏也含有较多的铜,人体血液中铜含量一般为1.1-1.5 mg/L。
作为人体必需的微量元素之一,铜是人体内蛋白质和酶的重要组分,许多关键酶需要铜的参与和活化,才能在人体代谢过程中发挥作用,促进人体的许多功能。如人体内氧化还原反应、组织呼吸、细胞生成、维持骨骼以及胶原组织结构等。 人体需求量
年龄(岁)/生理状况 | 参考摄入量 mg/d |
平均需要量 | 推荐摄入量 | 可耐受最高摄入量 |
1~ | 0.25 | 0.3 | 2.0 |
4~ | 0.3 | 0.4 | 3.0 |
7~ | 0.4 | 0.5 | 4.0 |
11~(男) | 0.55 | 0.7 | 6.0 |
11~(女) |
14~(男) | 0.60 | 0.8 | 7.0 |
14~(女) |
18~(男) | 0.60 | 0.8 | 8.0 |
18~(女) |
50~(男) | 0.60 | 0.8 | 8.0 |
50~(女) |
孕妇 | 0.7 | 0.9 | 8.0 |
乳母 | 1.1 | 1.4 | 8.0 |
铜缺乏的影响
但铜的缺乏或过量都会对人体健康造成影响。
铜缺乏可能来源于遗传缺陷(如Menke's综合征)或后天缺乏。Menke's综合征是一种罕见的X连锁遗传的铜代谢紊乱疾病,严重影响骨骼、软组织和神经系统。患者血液、肝、脑中铜含量低,但在某些组织器官中由于铜无法正常排出而产生聚集,血清铜和铜蓝蛋白含量降低,铜的吸收量减少。 铜的毒性
人体急性铜中毒较罕见,一般是摄入了被含铜容器污染的菜品和饮料所导致的。急性中毒症状包括流涎、上腹疼痛、恶心、呕吐和腹泻。急性铜中毒可引起肝损伤、高铁血红蛋白血症和溶血性贫血。可能导致急性肾功能衰竭,继发于大量血红蛋白尿。人体慢性铜中毒尚未进行广泛研究,但现有研究表明,慢性铜暴露会导致儿童腹泻,长期摄入自来水中含有的铜可引发胃肠道刺激,慢性铜暴露还可造成急性肝功能衰竭。 除此之外,铜烟还会引起金属烟雾热。据报道,摄入中毒物质后会有溶血性贫血。在较高剂量下,摄入的铜烟会引起溶血和对肝脏和肾脏的伤害。吸入铜烟会导致上呼吸道刺激,接触铜烟也会刺激眼睛、鼻子和喉咙。另外,铜烟也可能诱发易感个体的过敏性的接触性皮炎,体征和症状包括瘙痒、发红、肿胀、形成囊泡和脓疱。 铜对神经系统的作用
另外,铜被认为在神经系统疾病中起到关键作用,有推测显示铜诱导产生的羟基自由基可导致阿尔兹海默病中的神经退行性病变。也有研究显示铜可能参与了朊病毒介导的脑病中神经元损伤,但该证据较弱,很大程度上是一种推测,且没有迹象表明有任何神经元损伤效应与铜含量有关。目前人群流行病学研究也尚不能得出铜摄入量是否对认知减退有影响的结论。