鲁米诺
鲁米诺分子结构
鲁米诺(Luminol),别名发光氨、3-氨基邻苯二甲酸酰肼,是一种人工合成的有机化合物,可以3-硝基邻苯二甲酸为原料,通过高温肼解法、Gabriel反应等方式合成,分子式是C₈H₇N₃O₂,性状为黄色晶体或浅米色粉末,不溶于水,微溶于醇、醚,溶于二甲基亚砜、二甲基酰胺等极性有机溶剂以及碱性水溶液,在加热分解后会释放出有毒的烟雾,与强酸强碱以及强氧化剂和强还原剂不相溶。鲁米诺试在无机离子的分析方面、临床检验以及现代刑侦等方面都具有很重要的作用。 基本信息
性质
溶解性
不溶于水,微溶于醇、醚,溶于二甲基亚砜、二甲基酰胺等极性有机溶剂以及碱性水溶液
发现历史
1902年,施密茨(Schmitz)合成了鲁米诺。1928年联邦德国物理化学家阿尔布雷希特(H.Albrecht)对鲁米诺的化学发光现象进行了研究。1929年,哈维(Harvey)等发现在碱性介质中电解鲁米诺时,阴极和阳极附近的鲁米诺会发光,由此揭开了电致化学发光研究的序幕。20世纪60年代,库瓦纳(Kuwana)等研究了鲁米诺在铂电极上的电化学发光动力学和发光机理。
理化性质
物理性质
鲁米诺在常态下为黄色晶体或者米黄色粉末,熔点为280-330 ℃。鲁米诺溶于碱性溶液以及二甲基亚砜、二甲基酰胺等极性有机溶剂,微溶于酒精和乙醇,不溶于水。鲁米诺的中性或微酸性溶液在紫外光下会发出亮蓝色荧光,溶液pH在6-7时,溶液由橙色变蓝色。 化学性质
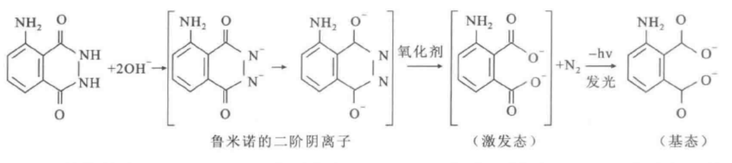
在碱性溶液中,鲁米诺能够被过氧化氢、高锰酸钾、次氯酸钠、活性氧等氧化剂氧化,鲁米诺的氧化产物吸收反应产生的能量会生成激发态的3-氨基邻苯二甲酸根离子,该离子的高能态不稳定,返回低能态的时候会将能量以光的形式释放。 过氧化氢是最常用的鲁米诺发光体系反应的氧化剂,血红蛋白、过氧化酶(常用辣根过氧化物酶)等金属配合物以及Fe³⁺、Fe²⁺、Co²⁺、Mn²⁺等金属离子能够加快鲁米诺与过氧化氢的反应速率。以过氧化物酶——辣根过氧化物酶(Horseradish Peroxidase,HRP)为催化剂,碱性条件下鲁米诺与过氧化氢反应的方程式如下: 发光机理
化学发光的发光基本原理,是指反应系统中某些化学物质因吸取了生化反映所排放的电能而由基态转移到受激态,又再由受激态回归到基态,进而使电能以光照射的形态释放出来,也因此形成了物理化学发光现象。 鲁米诺在中性溶液中通常以偶极离子存在,在碱性溶液中则会变成二价负离子且能被氧分子氧化成能够化学发光的中间体,该中间体处于激发态不稳定,衰变为基态时会发出荧光,反应方程式如下:
制备方法
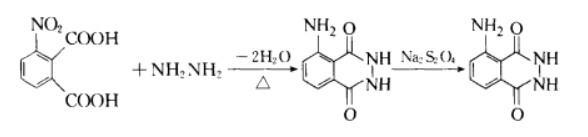
高温肼解法
高温肼解法是制备鲁米诺的经典方法,主要分为两步,第一步就是将起始原料3-硝基邻苯二甲酸与肼进行酰基的缩合反应,在这一步中需要注意的的是应当使用高沸点溶液进行反应,比如三甘醇或者丙三醇等高沸点溶剂,第一步反应将会得到得到3-硝基邻苯二甲酰肼,第二步反应则是将第一步反应得到的产物3-硝基邻苯二甲酰肼通过还原性物质比如二水合连二亚硫酸钠等,把硝基还原成氨基,便可得到最终产物鲁米诺。反应方程式式如下: 上述合成方法中存在以下四个问题:首先较高温度的苛刻条件会增大实验难度,并且收率比较低;其次有些合成方法中会用到毒性相对较高甚至剧毒的化合物,比如亚硝基化合物(中间体)和硫酸肼;然后这条路线也是非绿色合成路线,因为会产生大量的废液;最后,当第二步还原硝基时会有大量无机杂质产生,不利于反应后的分离提纯。 Gabriel反应合成
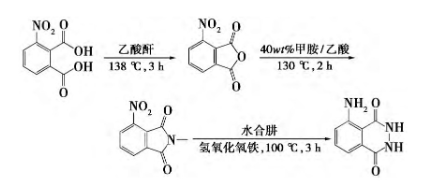
以3-硝基邻苯二甲酸为原料,中间体N-甲基-3-硝基邻苯二甲酰亚胺,最终得到鲁米诺。该方法合成主要涉及三步反应:a)中间体N-甲基-3-硝基邻苯二甲酰亚胺的合成;b)中间体与水合肼通过Gabriel反应生成环酰肼结构;c)苯环上硝基被过量催化剂FeOOH还原成氨基。该方法的优点是收率高、成本低、污染小且操作简单能极大缩短生产周期。 应用领域
无机分析
鲁米诺可用于无机物的化学发光分析,原理是利用物质对化学发光反应的催化和抑制作用可实现直接或间接测定。鲁米诺可以测定钴离子(Co²⁺)、铬离子(Cr³⁺)、铜离子(Cu²⁺)等离子,其中铬离子(Cr³⁺)的测定是鲁米诺分析应用比较成功的案例,测定的灵敏度和选择性都非常好,能够提高干扰离子的允许量。鲁米诺还可以用于测定溴、氯、砷等非金属元素或氧气、二氧化氮等化合物,如将含鲁米诺的滤纸作为固定相化学发光指示剂可以测定气体混合物中的过氧化氢,原则上也能测定任何一种通过反应能生成过氧化氢的物质;含的鲁米诺体系能够测定水中的氧、氯气、次氯酸等;鲁米诺体系测定二氧化氮时无需金属离子做催化剂,检测限能够达到50 pptNO₂。 临床检验
作为标记物
鲁米诺是芳香族的酰肼,它的各种衍生物能够比较容易地与分析物偶合,同时还能保留化学发光活性。比如有一些化学物质在特定酶的催化下会产生可以促进反应的H₂O₂,而产生的H₂O₂会进一步与鲁米诺体系进行化学发光反应,这样一来,根据化学发光反应的测定,由于结合酶反应具有专一性,便可以反推出这些化学物质的含量。这一类方法适用于复杂样品中的葡萄糖、尿酸、乳酸、胆固醇等化合物的光选择性检测。 还有就是通过将鲁米诺衍生物和鲁米诺相似物质标记在特定羧酸和胺类化合物上,随后进行色谱分离,最后在碱性环境下进行化学发光检测测定,也可用作化学发光免疫学研究的生物发光标记试剂,用来标记与氨基酸和蛋白质等生物相关的元素,从而进行化学发光免疫学研究。
作为发光增强剂
细胞吞噬同样会产生化学发光但是强度很弱,鲁米诺及其衍生物可以作为发光增强剂,使细胞吞噬产生的化学发光增强以便于检测。鲁米诺作为增强剂测定血液中中性细胞的化学发光应用较多,在此基础上能够测定血清调理素的活性,测定先天性中性粒细胞功能缺陷,监察机体的防御机能和药物对中性粒细胞的影响,从而知道临床治疗。
现代刑侦
鲁米诺和过氧化物(通常为过氧化氢)的混合物被称为鲁米诺试剂,鲁米诺试剂遇到血红素(heme)会出现很强的发光现象,这是因为血迹中的某些物质能催化过氧化氢分解。鲁米诺可用于现代刑侦的血液检测,其在干燥、陈旧的血迹上发光较新鲜血迹更为强烈、持久,并且发光结束后可以通过重新喷洒鲁米诺试剂使血迹重新发光。实验表明鲁米诺能检测出遗留室内长达17年的血迹,使用鲁米诺检测血迹已经成为现代刑侦中不可或缺的一种现场勘查手段。不过需要注意的是使用鲁米诺处理玻璃、陶瓷等非吸水性材料时,需要小心避免喷洒量过多而导致血迹“晕染”。
安全事宜
消防相关
泄漏处理
鲁米诺泄漏时,需要先逸出附近的火源,用甲苯润湿泄漏的鲁米诺,而后将鲁米诺转移到合适的容器中,然后使用蘸有甲苯的吸水纸清理剩下的鲁米诺,被鲁米诺污染的衣服和吸水纸需要密封在塑料袋中。所有受到鲁米诺污染的地面及物体表面需要使用甲苯溶剂清洗,然后使用肥皂液清洗。
毒理作用
鲁米诺吞咽有害,可能导致急性中毒,急性口服致死量为>500 mg/kg;对皮肤有刺激性,可能会腐蚀皮肤;眼睛接触鲁米诺会造成严重刺激或损伤;吸入鲁米诺可能会刺激呼吸道。
急救措施
眼镜接触鲁米诺,使用水或生理盐水冲洗眼睛20-30分钟,而后立即就医;呼吸道吸入鲁米诺,需要立即转移至无污染地区并呼吸新鲜空气,如出现咳嗽、呼吸急促等症状,即刻就医;口腔摄入鲁米诺不要催吐,如果当事人依旧有意识,可以喝一两杯水稀释化学品而后就医,如果当事人失去意识,要确保其呼吸畅通而后立即就医。