磷酸
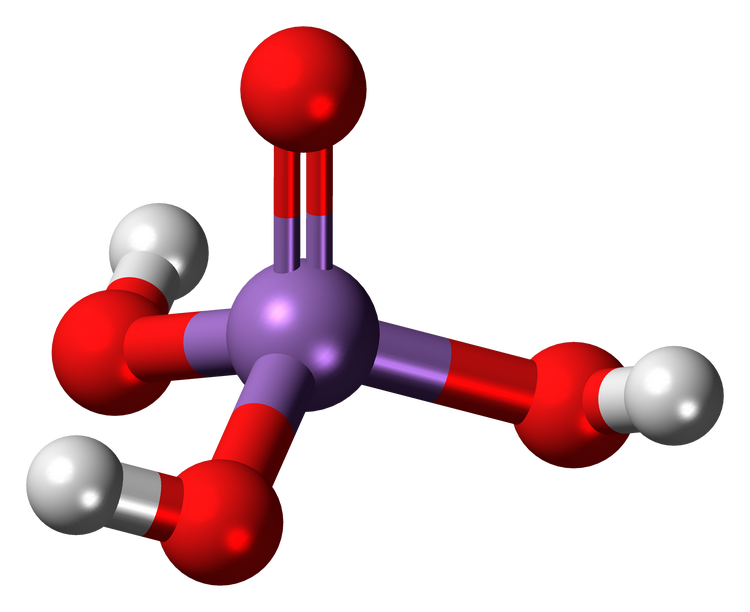
磷酸3D球棍模型
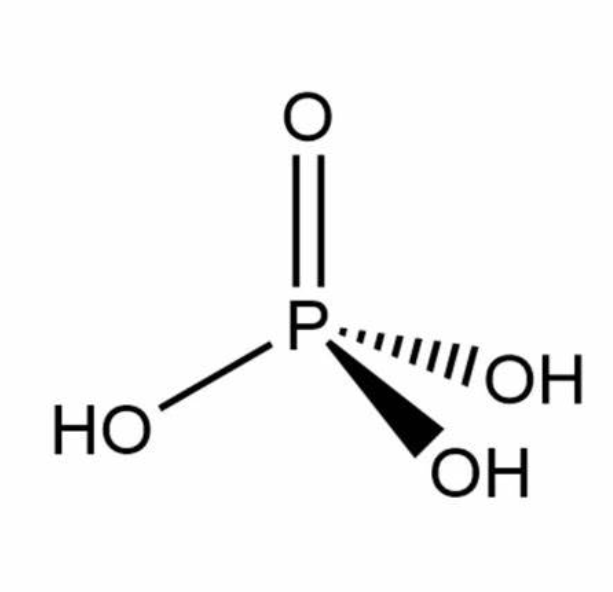
磷酸(英文名:Phosphoric acid)又名正磷酸,化学式为H3PO4,分子量97.995。磷酸是由五氧化二磷(P₂O₅)与水反应得到的化合物,是一种常见的无机酸。高浓度(83%-98%)磷酸呈无色透明粘稠液体,纯品为斜方晶系柱状结晶。磷酸挥发性不强,且不易分解,几乎没有氧化性。磷酸易潮解,易溶于水,能与水任意比例互溶,能溶于乙醇。磷酸酸性比盐酸、硫酸等强酸更弱,但比醋酸、硼酸等弱酸要强。磷酸常温下稳定,加热制成。磷酸可用于制造肥料、磷酸盐、药物、有机合成催化剂、陶瓷、玻璃等。磷酸是唯一一种可用于食品调味的无机酸,也可以作为食品酸味剂和化学试剂。 物质结构
在磷酸分子中,磷原子的价层电子构型为3s²3p²,经sp³不等型杂化4条杂化轨道。其中三条为具有单电子的杂化轨道,分别与—OH中的氧原子形成σ键;一条具有一对电子的杂化轨道,向端基氧原子配位,形成σ配键。除此之外,P原子除了sp³杂化轨道与四个氧原子形成配位σ键之外,还有两个空轨道分别接受配位原子上反馈回来的电子,形成p-d反馈大π键。因此磷酸根离子中P-O键长实测值为154pm,介于单键(171pm)与双键(150pm)之间。结晶状磷酸与其水合物的结构是由氢键相连接的PO₄四面体所组成,P-O键长为150x10ˉ¹²m,P-OH键长为155x10ˉ¹²m,键角OP(OH)为108°~115°,(OH)P(OH)为104°~110°。在浓溶液中仍然保持这些氢键,因此会表现出黏性。在浓度相对较低的稀溶液(54%H₃PO₄)中磷酸根离子则与水结成氢键。 化学性质
酸性
磷酸在水中的水解与电离如下:
脱水
与活泼金属反应
与碱和氨反应
磷酸能与NH₃、碱反应,由于磷酸是三元酸,因反应物的用量不同而能产生一种正盐和两种酸式盐: 与碱性氧化物反应
制备方法
实验室制法
磷酸在实验室中采用将硝酸氧化白磷制得纯H₃PO₄: 工业制法
磷酸的工业制造分为湿法磷酸和热法磷酸。从广义上说用酸分解磷矿制磷酸的方法称为湿法磷酸。通过氧化、水化而制成磷酸的方法称为热法磷酸。 湿法磷酸
湿法的使用无机酸来分解磷矿石制备磷酸。根据制备时选用无机酸的不同,又可以分成硫酸法、盐酸法、硝酸法等。由于在各种酸制备磷酸的过程中,由于硫酸法操作稳定技术成熟,分离容易,所以它是制造磷酸最主要的方法。 湿法磷酸生产中,硫酸分解磷矿是在大磷酸溶液介质中进行的。
实际的分解过程分为两步,首先是磷矿同磷酸(返回系统的磷酸)作用,生产磷酸二氧钙:
第二步时磷酸二氢钙和硫酸反应,使磷酸二氢钙全部转化为磷酸,并析出硫酸钙沉淀,反应式为 但由于磷矿中的杂质容易与硫酸产生副反应,对磷酸的生成有不利的影响,所以当天然磷矿中含有较多的氧化铁和氧化铝时,不适宜用硫酸法制备磷酸。 湿法磷酸因生产方法所限,成品酸不纯,对其精制的方法主要有溶剂萃取法、结晶法、离子交换法电渗析法、化学沉淀法。采用的二水物法流程生产的湿法磷酸中PO。通常采用直接接触蒸发和管式加热蒸发两种浓缩方法得到所需要的磷酸产品。 热法磷酸
热法是用黄磷燃烧并水合吸收所生成的P₄O₁₂来制备磷酸。热法磷酸的制造方法主要有液态磷燃烧法(又称二步法),二步法有多种流程,在工业上普遍采用的有两种。第一种是将黄磷燃烧得到五氧化二磷,用水冷却和吸收制得磷酸,此法称为水冷流程。第二种是将燃烧产物五氧化二磷用预先冷却的磷酸进行冷却和吸收而制成磷酸,此法称为酸冷流程。
应用领域
金属清洗防锈
磷酸作为无机强酸,对各种金属均有腐蚀,可以用于化学清洗(一般不采用磷酸清洗的方法,清洗时需要加入缓蚀剂)。用磷酸清洗的优点是钢铁表面自然形成防锈膜,即金属经可溶性的磷酸盐溶液处理,在其表面生成一层不溶性的磷酸盐膜。基于磷酸清洗液具有这个特点,可用于循环水系统检修开车时的清洗剂,达到防腐作用。
食品添加剂
磷酸为无色透明糖浆状液体,无臭,味酸。极易溶于水和乙醇,通常以含量为85%左右的商品出售。磷酸属强无机酸,其酸味度比柠檬酸大2.3一2.5倍,有强烈的收敛味和涩味,多用于可乐型饮料。有人说,“没有磷酸,就没有可乐”,磷酸是构成可乐风味不可缺少的风味促进剂。因其酸味强度大,故用量少,通常为0.6g/kg左右。 磷酸在酿酒时还可作为酵母的磷酸源,加强其发酵能力并能防止杂菌生长。在方便面和肉制品中常使用磷酸盐(三聚磷酸盐、焦磷酸盐和六偏磷酸盐等)以提高制品的保水性、吸油性等;磷酸还可用作螯合剂、抗氧化增效剂和pH调节剂及增香剂。用作酿造时的pH调节剂时,其用量在0.035%以下;在果酱中使用少量磷酸,以调节果酱能形成最大胶凝体的PH;在软饮料、糖果和焙烤食品中用作增香剂。生产汽水和酸梅汁用磷酸代替柠檬酸作酸味剂,其用量汽水为0.1%一0.15%,酸梅汁浓缩液为0.22%;啤酒糖化时用磷酸代替乳酸调节pH,用量为0.004%;作为酵母营养剂,促进细胞核生长,用量按干酵母计为0.53%。 燃料电池
碱性燃料电池在载人航天飞行中的成功应用,证明了以化学方式将化学能转化为电能的高效和可行性。其中以磷酸为电解质的磷酸型氢氧燃料电池首先取得突破。因为虽然AFC(碱性燃料电池,全称为:Alkaline Fuel Cells)具有高效发电的优点,但是将其应用在地面上的时候,由于CO₂所产生的毒化问题,它的应用受阻。这时,人们开始研究以酸作为电解质的燃料电池。磷酸由于具有较好的热、化学和电化学稳定性以及高温下挥发性小、独特的对CO₂的耐受力等优点而成为最早研制成功的地面用的燃料电池。 这项技术为基础建造的发电站运行在世界各地,实际应用表明,磷酸燃料电池是高度可靠的电源,可作为医院、计算机站的不间断电源。和其它燃料电池相比,磷酸电池的制作成本低,是发展最为成功的燃料电池之一。 安全事宜
毒理作用
毒性作用磷酸蒸气能引起鼻粘膜萎缩,在个别病例有刺激鼻翼并造成鼻中隔穿孔。有鼻出血、鼻和咽干燥、鼻内形成干痂皮、牙磨损的特征。 解剖中毒动物可见中毒性肺炎病灶,肺水肿,肺不张,肝肿大,有时呈颗粒状。对小白鼠及大白鼠的LD₅₀=1.25 g/kg,LC₅₀=25.5 mg/m³。受浓度为10.6 mg/m³长期染毒时,使血清蛋白含量增加及肝糖元降低。经一个月的恢复期之后,只有部分改变恢复正常。吸入浓度为2.3 mg/m³磷酸未引起病理改变及其他变化。 本品对皮肤有相当强的腐蚀作用,引起皮肤炎症性疾患。造成全身中毒现象。
环境危害
当贮存的磷酸发生泄漏时,首先疏散泄露污染区人员至安全区,建议应急处理人员戴好防毒面具,穿化学防护服,不直接接泄漏物,用沙土、干燥石灰或苏打灰混合,然后收集转移到安全场所或加入大量水中,调节至中性,再放入废水系统。如大量泄漏,收集回收或无害处理后废弃。废弃物处置方法:建议把废料缓慢地加到碱液——石灰水中.搅拌后,用大量水冲人下水道。如果是实验室少量泄漏,用大量水冲洗掉溢漏物,或者用碳酸氢钩(或小苏打粉和消石灰1:1混合物)覆盖后加水收集起,再用苏打溶液冲洗污染地面。 消防安全
当火灾燃烧中存在磷酸时,可以用雾状水、泡沫、砂土、二氧化碳灭火。同时注意不要使用柱状水,以防物料飞溅伤人,在火灾发生现场附近注意及时到上风口以防止吸入受热放出的有毒蒸气。
储存方法
储存于阴凉、通风的库房。远离火种、热源。包装密封,应与易(可)燃物、碱类、活性金属粉末分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
急救措施
溅入眼内时,须立即用大量清水冲洗;沾及皮肤时,可用大量清水或碳酸氢钠水洗涤,并用碳酸氢钠粉包扎伤处。