细胞融合/激活
4.1 融合与激活

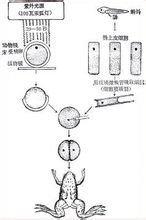
核移植
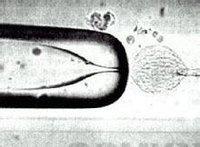
对兔卵电融合完成后,卵母细胞也因电刺激受到激活从而开始新的编程和发育,但对小鼠、大鼠和牛等还需进一步充分的激活才能获得发育。其方法有化学和电激活两种,化学激剂有7%乙醇、Ionomycin(离子霉素)、钙离子载体A23187,采用Ionomycin激活后再用6-DMAP处理3h,可避免出现PCC(早熟染色体凝集),并增加羊重构胚的发育率及出生率。 4.2 融合率与细胞期
Prather等(1989)研究结果表明,融合率与细胞期无显着差异,说明卵裂球体积变小对融合率并无显着的影响,张涌(1992)在小鼠研究中也得出类似的结果。Robal等也认为,融合率与受体卵母细胞的时龄有关,并且还与核供体接触的面积和接触的紧密程度有关,而与移入的卵裂球处于什么时期无关,但是重构胚的发育率与供体胚的细胞期是有关的。 4.3 温度、卵母细胞成熟时间对卵母细胞激活的影响
随着卵母细胞在体外成熟时间的延长,进而老化,成熟促进因子(MPF)下降,易激活。体外成熟老化的牛卵母细胞对温度诱导激活高度繁感,在一定的温度诱导激活下,卵母细胞染色质聚缩,"自动去核"的频率高。幼稚卵母细胞不容易在室温下激活,即使激活也不稳定,可能逆转到中期。