二氧化硫
二氧化硫(英文名称:SulfurDioxide),无机化合物,由硫元素和氧元素组成。化学式为SO2,别名亚硫酸酐、氧化亚硫,摩尔质量为64.07g/mol,密度为2.26g/cm。二氧化硫为具有强烈刺激性臭味的无色气体,容易液化,可溶于水、乙醇,常温常压下,1体积水能溶解40体积二氧化硫,是一种酸性氧化物,易于大多数碱性物质反应,并且具有氧化性和还原性,但还原性强于氧化性,还具有漂白性。实验室可以用亚硫酸钠固体或铜与浓硫酸反应来制取二氧化硫,工业上常通过焙烧硫或硫铁矿来制取二氧化硫。二氧化硫主要用于制造硫酸,也用于生产亚硫酸盐以及连二亚硫酸钠(俗称保险粉)等重要化工产品。二氧化硫也直接用作漂白剂、杀菌剂,广泛用于制浆、造纸、食品、饮料、水处理、防腐等许多重要领域。 基本信息
性质
密度
2.26g/cm(20℃)
在330kPa(20℃)时液化,液体的密度为1.43g/cm
危险性
二氧化硫对眼及呼吸道黏膜有强烈的刺激作用,大量吸入可引起肺水肿、喉水肿、声带痉挛而致室息。二氧化硫是造成大气污染的主要物质之一,排放到大气中的二氧化硫可形成酸雨,使水质酸化,导致水生态系统变化,浮游生物死亡,鱼类繁殖受到影响。
相关历史
早在1702年,德意志化学家施塔尔(G.E.GeorgErnstStahl)用碱性溶液吸收硫磺燃烧生成的气体,得到亚硫酸盐溶液,所以后来将这种气体叫做无水亚硫酸(即二氧化硫)。1774年,英国化学家约瑟夫·普里斯特利(J.JosephPriestley)在用硫酸做加热实验时,无意间将水银倒入热酸中,发现有大量白烟生成并有臭味发出,后来他又用铜、铁、银、硫分别和硫酸共热,都生成了这种具有恶臭的气体。此时他才知道这种气体是由硫元素和氧元素组成。1807年,法国物理学家、化学家约瑟夫·路易·盖-吕萨克(JosephLouisGay-Lussac)通过对硫酸盐的加热分解并收集,发现生成的无水亚硫酸和氧气在容量上的比为2:1,由此可得无水亚硫酸中的硫与氧的重量比为1:1,因为当时还没有分子的概念。直到阿伏伽德罗分子学说确立后,才知道无水亚硫酸的分子式为SO2。 来源
二氧化硫的唯一天然来源是火山爆发,自然界产生的二氧化硫只占总量中很少的一部分。环境中大部分的二氧化硫来自人为排放,主要有以下三个来源:①含硫矿物燃料的燃烧;②含硫矿物开采和有色金属的冶炼;③还有一部分来自化学工业的生产过程,例如石油精炼、硫酸、亚硫酸盐、硫化橡胶、漂白纸浆等含硫化合物制造工业。 体内代谢
大气环境中的二氧化硫主要经呼吸道进入机体,大部分在上呼吸道中被黏膜的湿润表面吸收(约40%~90%)。二氧化硫被吸收进入血液后立即与蛋白质结合(因此不能检测出游离的亚硫酸离子),并随血流分布到全身,在气管、肺门淋巴结和食道中含量较高。二氧化硫在亚硫酸氧化酶的作用下转化生成亚硫酸离子,再与蛋白质或小分子物质的硫化物键发生反应,形成R-S-SO3;最后经亚硫酸氧化酶催化与氧气结合生成SO4从尿中排出。亚硫酸氧化酶在肝脏最多,但在其他脏器也有分布。二氧化硫还能与起辅酶作用的维生素B1结合,破坏维生素B1与维生素C的结合,干扰体内维生素的平衡,从而影响机体的正常功能。
分子结构
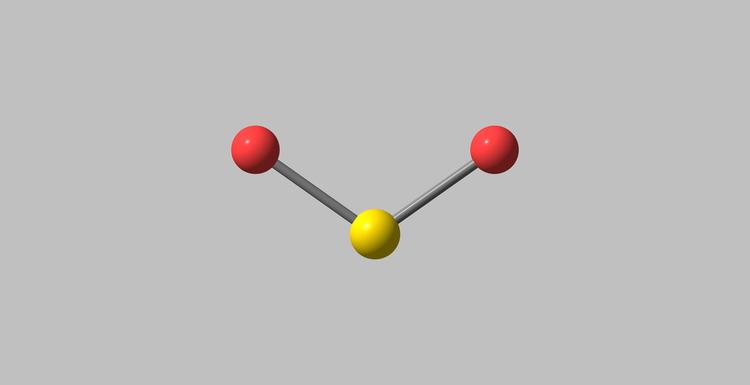
二氧化硫的分子呈V形结构,其成键方式与臭氧类似,硫原子sp杂化,硫原子和两个配位氧原子除了以键结合以外,还形成了一个三中心四电子的大键。 理化性质
物理性质
二氧化硫化学式为SO2,是一种具有强烈刺激性臭味的无色气体,可溶于水、乙醇,常温常压下,1体积水能溶解40体积二氧化硫,摩尔质量为64.07g/mol,密度为2.26g/cm,熔点为-75.5℃,沸点为-10℃。
二氧化硫气体易被液化,在330kPa(20℃)时液化,液体的密度为1.43g/cm。纯度为100%的二氧化硫气体在常温(30℃)下加压(绝对压力大于0.46MPa)可全部液化,在常压下用冷冻的方法(温度低于-10℃)也可以将二氧化硫全部转化为液体。工业生产液体二氧化硫,采用很高浓度(大于95%)或很低浓度(小于12%)的二氧化硫气体液化得到。
化学性质
与水反应
二氧化硫是酸性氧化物(亚硫酸的酸酐——亚硫酐),能与水反应生成亚硫酸。亚硫酸水溶液能被空气逐渐氧化为硫酸,浓度越低,氧化越快。亚硫酸水溶液一经加热就自行氧化。各反应式如下: 与碱性氧化物反应
与碱溶液反应
二氧化硫与碱溶液反应生成亚硫酸盐和水。
漂白性
二氧化硫跟某些有色物质化合生成无色物质而具有漂白作用(这与氯水的氧化性漂白作用实质不同),但无色物质不稳定,见光、遇热或长久放置又容易分解而恢复到原来的颜色。例如二氧化硫能使品红溶液褪色,加热后又恢复为红色。 氧化性与还原性
二氧化硫中硫元素为+4价,属于硫的中间价态(介于+2与+6之间),故二氧化硫既有氧化性,也有还原性(还原性强于氧化性)。
①还原性
二氧化硫能被氧气、卤素单质、过氧化氢、三价铁离子、高锰酸钾、硝酸等氧化剂氧化为+6价硫元素的化合物。 ②氧化性
二氧化硫具有弱氧化性,可以与硫化氢气体反应生成硫和水。
人体内源性二氧化硫
人体内含硫氨基酸经代谢后可产生SO2,其中L-半胱氨酸在半胱氨酸氧化酶的作用下氧化L-为半胱氨酰亚磺酸,L-半胱氨酰亚磺酸通过两条途径代谢,其中一条途径在谷氨酸草酰乙酸转移酶的作用下转氨基生成β-亚磺酰丙酮酸,后者自发分解为丙酮酸和SO2,SO2在体内与水结合产生SO3,SO3再经亚硫酸氧化酶生成SO4,最后经肾随尿液排出体外;L-半胱氨酰亚磺酸还可以被半胱氨酰亚磺酸脱羧酶脱羧生成CO2和次牛磺酸,大部分次牛磺酸参与结合胆汁酸的代谢。科学家经研究认为,微生物(如酵母)在吸收硫酸盐的过程中,通过减少3-磷酸腺苷-5磷酸硫酸而产生亚硫酸盐;应用氯酸盐(PAPS合成的特异性阻滞剂)可明显抑制被激活的中性粒细胞产生亚硫酸,同时过量的PAPS可部分阻断氯酸盐的抑制效应,上述研究表明亚硫酸盐至少部分是通过激活中性粒细胞中PAPS而产生的,激活的中性粒细胞也可在NADPH氧化酶的参与下使H2S氧化为亚硫酸盐。
内源性SO2在心血管系统调节中发挥着重要作用,它不仅具有舒张血管、抑制心脏功能、改善血管重构、抑制炎症反应、抗氧化以及调节脂质代谢等作用,而且对改善肺动脉高压、高血压和急性肺损伤等心肺血管疾病具有重要的病理生理学意义。研究表明,内源性SO2为心血管调节的新型气体信号分子。
制备方法
实验室制法
实验室可以用亚硫酸钠固体或铜与浓硫酸反应来制取二氧化硫。
工业制法
焙烧硫或硫铁矿
通过焙烧硫或硫铁矿来制取二氧化硫。
石膏煅烧还原
将石膏(或磷石膏)、焦炭和其他辅助材料放于回转窑中,在约1400℃煅烧,可以同时制得含二氧化硫气体和水泥熟料。 硫化氢燃烧
从天然气、石油、焦炉气和煤气化过程中回收的硫化氢气体,将其燃烧便可以获得二氧化硫气体。 废硫酸分解
从石油化工和炼油过程回收的废硫酸在870℃~1260℃的高温炉中分解可以得到二氧化硫、水蒸气和其他气体,然后再经洗涤、干燥可得到纯净的二氧化硫气体。 二氧化硫的提纯
液体二氧化硫的制造通常需要先制得纯二氧化硫气体,然后再经压缩、冷冻将其液化。具体方法如下:
哈涅希-希洛特法
该法创始于1884年,用水为吸收剂,(加压)吸收二氧化硫的溶液用蒸汽将其吸收,再经冷凝、干燥、液化。
氨-硫酸法
该法常用于一次转化的接触法硫酸厂尾气二氧化硫回收。以氨水为吸收剂,再用硫酸分解吸收液以制取二氧化硫气体。 发烟硫酸法
该法是Stauffer化学公司开发,是将已有的发烟硫酸或浓硫酸生产装置结合起来生产液体二氧化硫。反应式如下:
应用领域
水处理
在饮用水、污水和工业废水的处理中,使用二氧化硫来消毒和消除氯化过程中残留的氯气。液体的二氧化硫使用方便,易于自动化且成本低,大型工厂趋向于用其取代亚硫酸盐和亚硫酸氢盐。 葡萄酒的酿造
在葡萄酒酿造过程的不同工序中,加入不同量的二氧化硫,其目的在于使发酵得以顺利或有利于葡萄酒的储存。加入二氧化硫有杀菌、澄清、抗氧、溶解、增酸和改善口味等作用。
食品领域
在食品工业中二氧化硫广泛用作熏煮剂、防腐剂、漂白剂和谷物浸渍剂。用二氧化硫漂白茶叶,可防止去皮和切片时颜色变褐。制葡萄酒时,少量的二氧化硫可杀死细菌、霉菌和野酵母而不损伤发酵的酵母。葡萄酒瓶也用二氧化硫消毒。制麦芽过程用二氧化硫处理可防止啤酒中亚硝酸胺生成。在糖浆制造、糖精制过程中,二氧化硫有漂白和抑止微生物生成双重效用。在制高梁糖糖浆时,二氧化硫生成亚硫酸氢钠在酶催化异构化过程中抑止不希望生长的微生物。玉米浸渍湿磨早期,0.1%~0.2%(重量)二氧化硫溶液亦起到上述作用,并阻止Maillord反应。 选矿和电解炼铜
在选矿时,二氧化硫和其五硫酸盐是硫化物矿的浮选抑止剂。从含铜矿石浸取液中电解冶炼铜时,二氧化硫把三价铁离子还原为二价铁离子,提高电流效率和铜阳极质量。二氧化硫可以从炼铜副产物亚硒酸中引发金属硒的沉淀。 化工领域
二氧化硫主要用于制造硫酸,也用于生产亚硫酸盐以及连二亚硫酸钠(俗称保险粉)等重要化工产品;在邻二甲苯或萘氧化为邻苯二甲酸酐工艺中作为助催化剂或催化改性剂;是制溴抗氧剂;又是糠基树脂快速固化催化剂。 安全事宜
安全标识
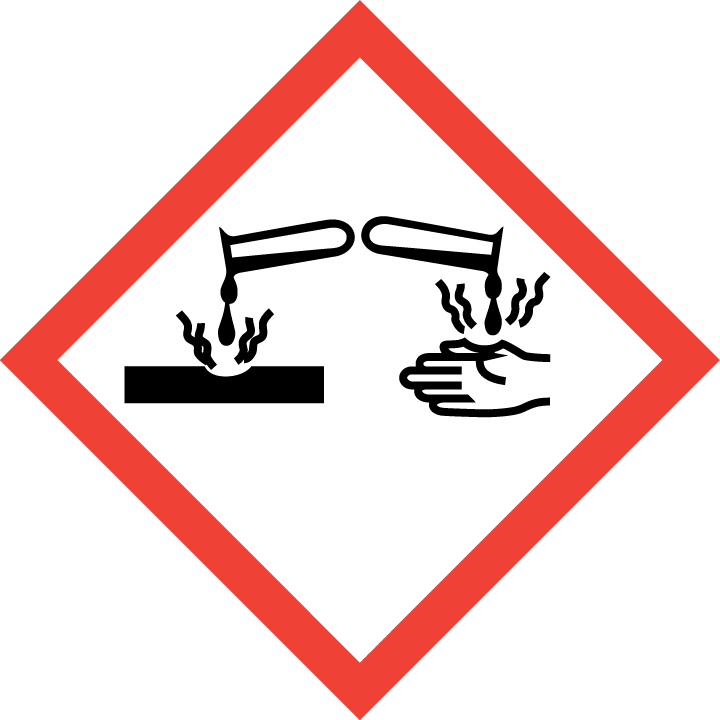
GHS分类
GHS | 危险说明 | 危险等级 |
H314 | 造成严重的皮肤灼伤和眼睛损伤 | 皮肤腐蚀/刺激 |
H331 | 吸入有毒 | 急性毒性,吸入 |
毒性与接触
刺激性:家兔经眼:6x10/4h,32d,轻度刺激。
致突变性:DNA损伤:人淋巴细胞5700x10。DNA抑制:人淋巴细胞5700x10。
生殖毒性:大鼠吸入最低中毒浓度(TCL0):4mg/m,24h(交配前72d),引起月经周期改变或失调,对分娩有影响,对雌性生育指数有影响。
暴露途径:吸入,当空气中的二氧化硫浓度达20×10时可引起眼结膜炎、急性支气管炎,极高浓度时可导致声门水肿、肺水肿和呼吸道麻痹。
环境影响
二氧化硫是造成大气污染的主要物质之一。二氧化硫在大气中经过复杂的变化,成为硫酸和硫酸盐,能伤害植物叶片,浓度高时,会使植物枯死。排放到大气中的二氧化硫可形成酸雨,使水质酸化,导致水生态系统变化,浮游生物死亡,鱼类繁殖受到影响。酸雨还会危害森林,破坏土壤,使农作物产量降低,而且还会腐蚀石刻、建筑。
泄露处理
迅速撤离泄漏污染区人员至上风处,并立即进行隔离,小泄漏时隔离150m,大泄漏时隔离450m,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防毒服。从上风处进入现场。尽可能切断泄漏源。用工业覆盖层或吸附/吸收剂盖住泄漏点附近的下水道等地方,防止气体进入。合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。如有可能,用一捉捕器使气体通过次氯酸钠溶液。漏气容器要妥善处理,修复、检验后再用。
消防处理
二氧化硫不可燃。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服,在上风向灭火。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷场地。
健康危害
二氧化硫易被湿润的黏膜表面吸收生成亚硫酸、硫酸。对眼及呼吸道黏膜有强烈的刺激作用。大量吸入可引起肺水肿、喉水肿、声带痉挛而致室息。①急性中毒:轻度中毒时,主要表现有眼及呼吸道黏膜的刺激症状,如眼睛灼伤、流泪、畏光、咳嗽,结膜及咽喉充血等;严重中毒可在数小时内发生肺水肿;极高浓度吸入可引起反射性声门痉挛而致室息。②慢性影响:长期低浓度接触,可有头痛、头昏、乏力等全身症状,以及慢性鼻炎、咽喉炎、支气管炎、嗅觉及味觉减退等。
急救措施
皮肤接触:立即脱去被污染的衣着,用大量流动清水冲洗。就医。
眼睛接触:提起眼脸,用流动清水或生理盐水冲洗。就医。 吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
储存与运输
二氧化硫属于无机酸性腐蚀物品。贮存钢瓶应在低温、通风良好场所,避免日晒,远离高温物体。贮运时严禁泄露,搬运钢瓶时应轻拿轻放,切勿激烈振荡,避免引起爆炸。