红磷
红磷(英语:Phosphorus Red,RP),也称为赤磷,是磷的一种同素异形体,其他同素异形体还有白磷、黑磷。其化学式为P,相对原子质量为30.97 g/mol,相对密度2.34 g/cm,熔点590 ℃ ( 4357 kPa),自燃点260 ℃(在空气中)。常温下为紫红色粉末,无臭,无毒,能溶于无水酒精,不溶于水,二硫化碳 红磷在常温及潮湿的条件下,与水蒸气和氧缓慢地起反应。在加热条件下,能与氧相互作用生成P4O10和P4O6的氧化物;与金属作用生成磷化物,能与卤素和硫起反应。在强碱中煮沸生成PH3和亚磷酸盐。红磷汽化后再凝华则得白磷。红磷稳定性比白磷好。红磷高度易燃,与氧化性物质混合有爆炸性。 红磷多用于生产火柴、烟火药、氧化剂和阻燃剂等。
历史
1845年,德国人施罗脱发现了红磷,1848年,德国化学家波特格尔率先将其用于制备安全火柴,1855年,瑞典人丁·伦德斯特姆于瑞典生产出安全火柴,1865年,安全火柴传入中国,被称为洋火或自来火,1879年,中国第一家火柴厂在广东佛山创办。
物质结构
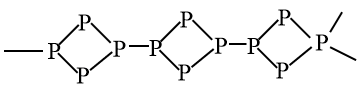
红磷有多种结构,较为常见的一种是由9个磷原子连接成的稠环结构,另外一种则是由Р4四面体的一个P-P键断裂后相互结合起来的链状结构,如图所示:
理化性质
物理性质
常温下,红磷是紫红色粉末,无臭,无毒,在暗处发磷光,经摩擦极易燃烧,燃烧时散发出有毒、有刺激性的氧化磷烟雾。相对密度2.34 g/cm,熔点590 ℃ ( 4357 kPa),自燃点260 ℃(在空气中),429 ℃升华,比重2.2,介电常数4.1,熔化热和汽化热分别为18.2 kJ/mol、32.2kJ/mol。能溶于无水酒精,不溶于水,二硫化碳。 化学性质
与空气反应
红磷的化学活性介于白磷和黑磷之间。在常温下,干燥的红磷化学性质稳定,即使在200℃下,也只生成微量PH3、H3PO2、H3PO3及H3PO4等,但在4300 kPa压强下加热至590 ℃会熔融,汽化后再冷凝可得白。并且红磷在水蒸气和氧气存在的条件下还可以发生一系列的重要反应,形成酸的氧化物和高毒性磷化氢(H3P),痕量金属的存在可对此反应起到催化作用,实验表明,铜、铋、铁、银、镍可大大增加红磷的氧化速度,而铝和锌能够减少红磷的氧化速度。金属氢氧化物也是红磷很好的氧化抑制剂,氢氧化铝的效果最好。 燃烧与爆炸
红磷在空气中的自燃温度约为260 ℃,遇热、火种、摩擦和撞击极易燃烧。与溴、氯气等混合能发生燃烧。与大多数氧化剂,如氯酸盐、硝酸盐、高氯酸盐或高锰酸盐等组成的混合物具有十分敏感的爆炸性能。如氯酸钾与红磷混合后,即使在含有水分的情况下,稍经摩擦或撞击就会燃烧或爆炸。 其他反应
红磷还能与卤素和硫起反应。在强碱中煮沸生成PH3和亚磷酸盐。
生产工艺
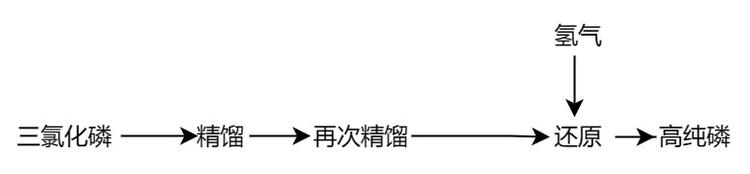
三氯化磷还原法
该方法的主要流程是:用三氯化磷的分析纯试剂作原料,在特定的填料式精馏柱中进行精馏提纯,必要时,再精馏一次。精馏得到的精馏液通氢还原,即可得到高纯磷。将获得的白磷转移到另一玻璃管中,抽真空封闭后逐步加热至300~350℃ ,约经过一周即全部转化为赤磷。 直接蒸馏法
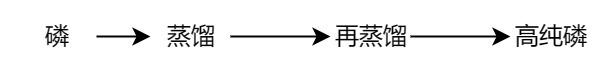
直接蒸馏法的主要步骤是两次蒸馏。第一次蒸馏的原料是工业磷,得到的初馏液另放,作下次原料;中段馏液作为中间品(半成品);残留液可作原料,但只能反复利用三次,否则要影响产品质量。
第二次蒸馏的原料是上述中段馏液,两次蒸馏后即可得到高纯磷。将所得产物装进硬质的玻璃管中,移至管式电炉内,在通氮下进行加热保温数小时后,进行冷却,即得高纯赤磷。 直接蒸馏法是大量生产高纯磷的好方法,由于蒸馏设备还不够精密,其最高纯度只能达到99.999 %,如多次蒸馏也无显著的提高。用直接蒸馏法所得的高纯磷,如再转化为三氯化磷,然后还原制备元素磷,其纯度可达99.9999%。 区域熔炼法
磷经三次区域熔行程后,可得无机杂质总量<1×10、有机杂质总量<1×10的高纯磷。用区域熔炼提纯法可大量制取高纯磷,而设备费用很低,产品纯度可达99.9999%。
应用领域
轻工业
红磷(RP)在轻工业上主要用于制造火柴,将赤磷、硫化锑和胶的混合物涂于火柴盒的侧面,当火柴头(氯酸钾、硫化锑、玻璃粉和胶等)在上面摩擦时就生热,在热的影响下,少量赤磷就转为黄磷,再由黄磷的燃烧引起火柴头发生化学反应而燃烧。 塑料工业
红磷是单质磷的一种同素异形体,是一种相对无毒的物质,可以作为阻燃剂,系无机添加型阻燃剂,其用量仅次于卤系阻燃物,可广泛用于聚烯经、聚氮酯、聚碳酸酯、聚酯、聚甲醛、环氧树脂、ABS树脂、聚酰胺、橡胶、尼龙和纤维织物等阻燃制品中,是优良的阻燃试剂。红磷作为非卤高效阻燃剂,经改性处理后,由于其有效磷含量高、用量少、阻燃效率高、发烟量少、毒性低、价格低廉和与聚合物材料相容性好等优点而备受好评。红磷作为典型的无机试剂,用红磷阻燃的树脂一方面在燃烧时生成氧化磷,氧化磷可促进树脂脱水、炭化,使可燃产物减少,然后生成磷酸、亚磷酸、聚偏磷酸等,在树脂表 面形成一层玻璃状熔融物,阻止火焰向聚合物表面 传递热和由聚合物表面向外扩散分解产物,成为障碍层,从而抑制了燃烧的蔓延;另一方面,此过程还具有吸热作用,降低聚合物自身的氧化热,达到固相阻燃的目的。是红磷在实际应用中存在许多问题,如易吸潮、氧化,可放出有毒气体,粉尘易爆炸,在与树脂混炼、模塑等加工过程中存在着火危险,且与树脂的相容性较差,不易分散均匀,导致基材物理性能下降。为了解决这一问题,市场上出现了微胶囊红磷阻燃剂,它的出现大大提高了红磷与个聚合物的相客性。提升了红磷的着火温度。 军事领域
红磷在军事领域内亦有诸多用途,包括:屏蔽烟幕弹、信号烟幕弹、红外诱骗弹、燃烧弹等。根据不同用途改变RP的形态和化学反应活性。例如,用于信号烟幕弹时,可将RP制造成燃速很慢的弹药,从而长时间地释放出烟幕;也可以将RP制造成燃速很快的颗粒或薄膜来发射IR信号。为了提高燃速,RP与金属燃料和氧化剂混合,能快速形成厚重的烟幕云。 其中最重要的应用是烟火药烟幕弹和屏蔽弹。RP是制造高能、多谱段烟幕弹和屏蔽弹的基本原料。以RP为基材的烟幕弹的生产过程是对环境有害和产生污染的,因此在生产之前必须将其封装,然后将其与黏结剂、氧化剂及其他添加剂混合,最后将混合物加工成所需的形状。
其他
在冶金工业上红磷被用以制造磷铜片。在化学工业上,红磷可以用来制造磷酸、磷酐、五氧化磷、三氧化磷等含磷化合物的原料和有机磷农药、杀鼠剂、化肥及其他有机合成产品。另外,电子级红磷是半导体的掺杂、扩散剂,是化合物半导体GAP、INP的主要原料。
安全事宜
毒性
红磷对生物有一定毒性,对于动物,会引起血红蛋白、红细胞和白细胞的数量降低及肝、肾的病理学改变(Heimann)。对人体,急性作用主要为皮表烧伤、粘膜刺激、致肝、肾、心等多脏器损害,赤磷毒性低,可引起皮炎,如制品不纯时可含少量黄磷,可致黄磷中毒,经常吸入红磷尘,可引起慢性磷中毒。男性的最低致死剂量为4412 ug/kg。 急救措施
基于以上健康威胁,操作人员应当佩戴防尘口罩;必要时戴安全防护眼镜;穿工作服;戴防护手套。工作现场严禁吸烟。工作后,淋浴更衣。 接触后,应采取急救措施。皮肤接触:脱去污染的衣物,立即用清水彻底冲洗,就医。眼睛接触:立即提起眼睑,用流动清水或生理盐水冲洗至少15 min。吸入:迅速脱离现场至空气新鲜处,必要时进行人工呼吸,就医。食入:误服者给充分漱口、饮水,就医。 消防措施
红磷的环境危害主要是由于红磷遇热、火种、摩擦撞击或溴,氯气等氧化剂都有引起燃烧的危险。与氧酸钾混合后,即使在含水分的情况下稍经摩擦或撞击也会燃烧爆炸。
基于此,在操作红磷时应当有一定的安全培训。
泄露处理:隔离泄漏污染区,周围设警告标志,切断火源。建议应急处理人员戴好防毒面具,穿相应的工作服。用水润湿,使用无火花工具收集于干燥、洁净、有盖的容器中,倒至空旷的地方,干燥后即自行燃烧。如果大量泄漏,与有关技术部门联系,确定清除方法。 灭火方法:小火可用干燥沙土闷熄。大火用水灭火。待火熄灭后,须用湿沙土覆盖,以防复燃。清理时须防止灼伤。
灭火剂:冒烟及初起火苗时用黄沙、干粉、石粉;大火时用水,但应注意水的流向,以及红磷散失后的场地处理,防止复燃。
储存方法
储存于阴凉、通风的库房。远离火种、热源。库温不超过32℃,相对湿度不超过80%。应与氧化剂、卤素、卤化物等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。禁止震动、撞击和摩擦。