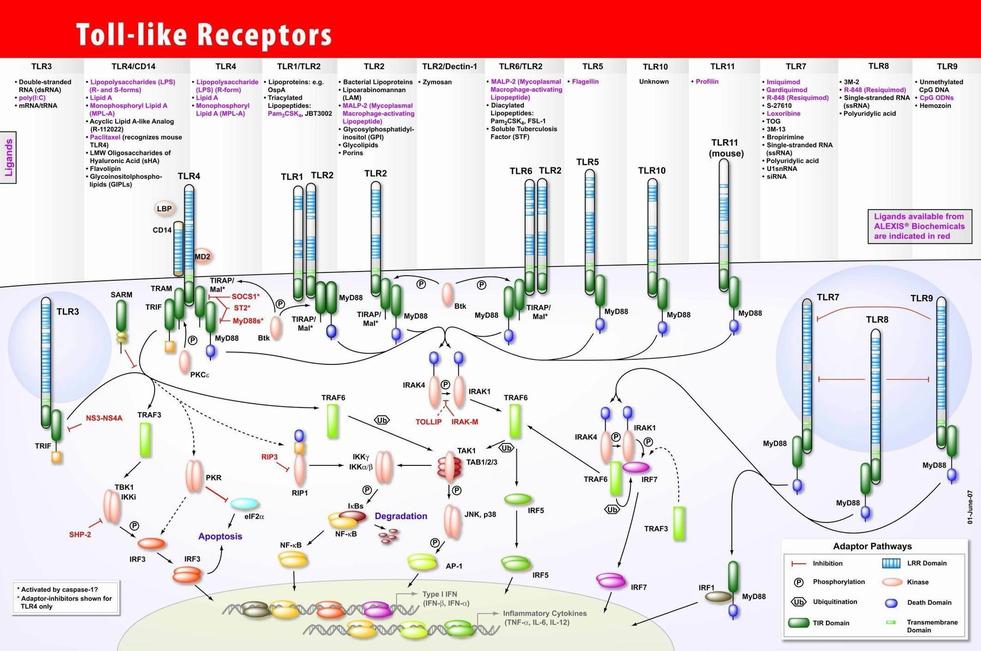
TLR如同天然免疫的眼睛,监视与识别各种不同的疾病相关分子模式(PAMP),是机体抵抗感染性疾病的第一道屏障。其中TLR4不但可识别外源的病原体,还可识别内源性物质及降解物。 ●TLR1的主要配体为分歧杆菌,细菌中的脂蛋白和三酰脂质肽。 ●TLR4可以识别革兰氏阴性菌脂多糖(LPS),还可识别宿主坏死细胞释放的热休克蛋白(heat-shockproteins,HSP),体内类肝素硫酸盐和透明质酸盐降解的多糖部分以及局部的内源性酶的级联活化反应也可激活TLR4。 ●TLR2的配体较TLR4的广泛,包括脂蛋白,脂多肽,脂肪酸(LTA)阿拉伯甘聚糖(LAM)及酵母多糖等。
●TLR3特异识别病毒复制的中间产物ds-RNA,从而激活NF-кB和干扰素IFN-β前体。DoyleS E等证实,抗TLR3单克隆抗体能抑制成纤维细胞IFN-β的产生。Christopher A等证实TLR3还具有调控鼻病毒对人支气管细胞感染的能力,这也说明了TLR3在宿主抵抗活病毒中发挥重要的作用。 ●TLR7识别咪喹啉家族低分子量的咪唑莫特、R-848和R-847等。
TLR7、TLR8和TLR9高度同源,与其他TLR不同,它们在细胞内涵体中起作用,吞噬和包膜溶解后结合它们的配体,可识别微生物的核酸。
●TLR9识别细菌的CpG-DNA,激活B细胞和APC的免疫刺激特性。 另外,TLR对配体的识别,不同类型的TLRs可以组合,从而识别不同的PAMPs,如TLR1与TLR6可以协同TLR2对不同的PMAPs分子进行组合识别;TLR7可能同TLR9组合来介导CpG激活免疫细胞。其中TLR4/TLR4和TLR9/TLR9是以同源二聚体的形式进行;而TLR2/TLR4、TLR2/TLR6和TLR7/TLR8为异源二聚体,还有的二聚体中有一个亚单位尚未确定,如TLR3/TLR、TLR5/TLR。 Toll样受体在获得性免疫系统中的作用
首先,Toll样受体在获得性免疫中的具有识别作用。机体最强的抗原呈递细胞——树突细胞可表达TLR。借助TLR识别LPS、GpG-DNA、肽聚糖、脂蛋白以及分支杆菌的细胞壁成分等具有PAMP的分子,树突细胞被活化而成熟,提供获得性免疫的共刺激信号。因此TLR是微生物成分引起树突细胞活化的桥梁。 第二,Toll样受体对获得性免疫应答类型具有调控作用。多数TLRs活化后可以诱导抗微生物防御系统,产生IL-1β、IL-6和TNF以及趋化型细胞因子,从而调节机体Th1和Th2两种方面的平衡。
具体地说,TLR3、TLR7/TLR8、TLR9在病毒核酸成份的刺激下,诱导机体产生I型干扰素,后者发挥抗病毒免疫作用。TLR2和TLR4激活DC后产生不同的细胞因子和化学激活因子。TLR4主要产生IL-12 p70,IFN-γ介导蛋白(IP-10)及转录IFN-β。TLR2刺激则优先表达IL-8和IL-23。这些可溶性细胞因子诱导T辅助细胞向有利于杀灭病原的方向分化产生细胞免疫应答或体液免疫应答。尤其是IL-12和IP-10能够刺激T细胞产生IFN,促使Th细胞分化为Th1细胞。如果缺乏IL-12则分化为Th2细胞。 另一方面,TLR2优先激活p19的转录。p19是近期才被证明的一种可以和p40形成杂二聚体的蛋白,与IL-12具有相似的作用。TLR4激动剂可刺激大量产生IP-10。IP-10是不同细胞对IFN-γ、微生物成分应答后产生的CXC化学激活因子,可对单核细胞、NK细胞产生化学吸附作用,更重要的是Th1型细胞优先表达IP-10受体CXCR3,但TLR2刺激DC不能表达IP-10。