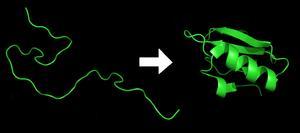
蛋白质结构
蛋白质分子的结构决定了它的功能。
一级结构:蛋白质多肽链中氨基酸的排列顺序,以及二硫键的位置。 二级结构:蛋白质分子局区域内,多肽链沿一定方向盘绕和折叠的方式。 三级结构:蛋白质的二级结构基础上借助各种次级键卷曲折叠成特定的球状分子结构的空间构象。四级结构:多亚基蛋白质分子中各个具有三级结构的多肽链,以适当的方式聚合所形成的蛋白质的三维结构。 连接方法:用约20种氨基酸作原料,在细胞质中的核糖体上,将氨基酸分子互相连接成肽链。一个氨基酸分子的氨基,脱去一分子水而连接起来,这种结合方式叫做脱水缩合。通过缩合反应,在羧基和氨基之间形成的连接两个氨基酸分子的那个键叫做肽键。由肽键连接形成的化合物称为肽。 蛋白质折叠
蛋白质折叠
根据克里斯琴·B·安芬森(1972年的诺贝尔化学奖得主)的研究,蛋白质可由加热或置于某些化学环境而变性,三级结构解体;而当环境回复到原本的状态时,蛋白质可于不到一秒的时间折叠至原先的立体结构,不论试验几次,蛋白质都仅此一种立体结构,于是Anfinsen提出一个结论:蛋白质分子的一级结构决定其立体结构。 安芬森的研究结果非常重要,因为蛋白质的功能取决于其立体结构,而目前根据已知某基因序列可翻译获得对应蛋白质的氨基酸序列,既蛋白质的一级结构;如果从蛋白质的一级结构就能知道立体结构,那么即可直接从基因推测其编码蛋白质所对应的生物学功能。虽然蛋白质可在短时间中从一级结构折叠至立体结构,研究者却无法在短时间中从氨基酸序列计算出蛋白质结构,甚至无法得到准确的三维结构。因此,研究蛋白质折叠的过程,可以说是破译“第二遗传密码”——折叠密码(foldingcode)的过程。 目前蛋白质的再折叠依然遵从先使用胍或脲变性,然后逐渐降低降低胍或者脲的浓度,也就是逐渐降低对蛋白质天然“回缩”能力的干扰。使其自然回到天然的最低能量状态。只是这个过程无法很好的控制肽链与肽链之间和肽链内部形成错误折叠的干扰。
在生物体内,生物信息的流动可以分为两个部分:第一部分是存储于DNA序列中的遗传信息通过转录和翻译传入蛋白质的一级序列中,这是一维信息之间的传递,三联子密码介导了这一传递过程;第二部分是肽链经过疏水塌缩、空间盘曲、侧链聚集等折叠过程形成蛋白质的天然构象,同时获得生物活性,从而将生命信息表达出来;而蛋白质作为生命信息的表达载体,它折叠所形成的特定空间结构是其具有生物学功能的基础,也就是说,这个一维信息向三维信息的转化过程是表现生命活力所必需的。
结构决定功能,仅仅知道基因组序列并不能使我们充分了解蛋白质的功能,更无法知道它是如何工作的。蛋白质可凭借相互作用在细胞环境(特定的酸碱度、温度等)下自己组装自己,这种自我组装的过程被称为蛋白质折叠。
蛋白质折叠问题被列为“21世纪的生物物理学”的重要课题,它是分子生物学中心法则尚未解决的一个重大生物学问题。从一级序列预测蛋白质分子的三级结构并进一步预测其功能,是极富挑战性的工作。
自从20世纪60年代,Anfinsen基于还原变性的牛胰RNase在不需其他任何物质帮助下,仅通过去除变性剂和还原剂就使其恢复天然结构的实验结果,提出了“多肽链的氨基酸序列包含了形成其热力学上稳定的天然构象所必需的全部信息”的“自组装学说”以来,随着对蛋白质折叠研究的广泛开展,人们对蛋白质折叠理论有了进一步的补充和扩展。Anfinsen的“自组装热力学假说”得到了许多体外实验的证明,的确有许多蛋白在体外可进行可逆的变性和复性,尤其是一些小分子量的蛋白,但是并非所有的蛋白都如此。而且由于特殊的环境因素,体内蛋白质的折叠远非如此。 体内蛋白质的折叠往往需要有其他辅助因子的参与,并伴随有ATP的水解。因此,Ellis于1987年提出了蛋白质折叠的“辅助性组装学说”。这表明蛋白质的折叠不仅仅是一个热力学的过程,显然也受到动力学的控制。有的学者基于有些相似氨基酸序列的蛋白质具有不同的折叠结构,而另外一些不同氨基酸序列的蛋白质在结构上却相似的现象,提出了mRNA二级结构可能作为一种遗传密码从而影响蛋白质结构的假说。但目前为止,该假说尚没有任何实验证据,只有一些纯数学论证。那么,蛋白质的氨基酸序列究竟是如何确定其空间构象的呢?围绕这一问题科研人员已进行了大量出色的工作,但迄今为止我们对蛋白质的折叠机制的认识仍是不完整的,甚至有些方面还存在着错误的观点。