钠
Na
钠(英文名:Sodium)是一种碱金属化学元素,元素符号为Na,位于第三周期第ⅠA族,属于s区元素,原子序数为11、原子量为22.99,其电子排布为1s²2s²2p⁶3s¹。通常情况下,常温下的钠为质地软、轻、蜡状且伸展性极好的银白色金属固体,20 ℃时的密度为971 kg/m³,熔点为97.81 ℃,沸点为881.4 ℃,可溶于液氨、汞,不溶于苯、石脑油、煤油。钠的化学性质活泼,在空气中容易发生氧化转变为暗灰色,可与许多金属、非金属和有机物发生化学反应。钠有22种同位素,分别为¹⁸Na-³⁷Na,Na是唯一稳定的同位素,其他同位素都带有放射性。 在自然界中,钠仅以化合物的形式广泛地分布于陆地和海洋中,是地壳中含量排名第六的元素。钠是动植物的必需元素,钠广泛存在于人体肌肉组织和神经组织中,是细胞外液的主要阳离子,起到维持渗透压、维持酸碱平衡、维持神经和肌肉的正常兴奋性的等作用。 由于钠活泼的化学性质,在许多情况下都具有一定的危险性。如钠在遇水或暴露在潮湿空气中会发热,且极易引起燃烧或爆炸。对于钠的消防处理,只能采用干沙或干粉进行灭火。
工业上常用的生产钠的方法是通过电解熔融氯化钠制备。钠广泛用于化工生产、照明行业、电池行业和钢件淬火中。
发现历史
1807年,英国化学家汉弗里·戴维(Humphry Davy)通过电解熔融氢氧化钠首次分离获得了质地柔软的银白色钠。相关化学反应方程式如下: 1891年,采用电解熔融氢氧化钠制备金属钠用于工业生产的方法获得首次成功。
1921年,电解氯化钠制备金属钠的方法开始用于工业生产。
分布情况
在自然界中,钠不以单质形式存在,通常以化合物(钠盐)的形式广泛地分布于陆地和海洋中,其在海水中的含量约为2.7%,在地壳中含量约占2.4%,是地壳中排名第六的元素。海洋、盐湖和盐井是重要的钠资源,对于矿物来说,钠主要存在于岩盐、天然碱,硝石和芒硝中。 钠也是人体中的重要元素成分之一,成人体内钠含量为6200-6900 mg/kg。钠广泛存在于人体肌肉组织和神经组织,且通常情况下约44%-50%的钠存在于细胞外液中,40%-47%的钠存在于骨骼中,9%-10%的钠存在于细胞内液。 物质结构
原子结构
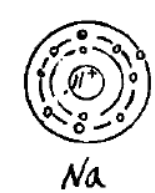
钠原子的原子半径为0.186 ,其核外电子排布为1s²2s²2p⁶3s¹,由一个带11个正电荷的核和核外11个电子组成。核外11个电子分为三个电子层,由内向外分别含有2个、8个和1个电子。因此钠的原子结构不稳定,在发生反应时更倾向于失去最外层的单个电子形成8个电子的最外层电子层形成稳定结构。
晶体结构
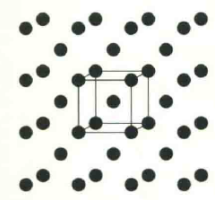
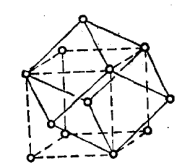
钠晶体属于金属晶体,钠原子之间以金属键相互作用。钠的晶胞中含有2个钠原子,分别位于晶胞中的原点和体心。
钠晶体为体心立方结构,每个钠原子周围都含有8个相邻的钠原子,这8个钠原子形成一个平行六面体结构单元,只包含一个钠原子。
理化性质
物理性质
通常情况下,常温下的钠为质地软、轻、蜡状且伸展性极好的银白色金属固体,20 ℃时的密度为971 kg/m³,熔点为97.81 ℃,沸点为881.4 ℃,可溶于液氨、汞,不溶于苯、石脑油、煤油。在干燥空气中钠可在>115 ℃的温度条件下发生自燃。钠的临界点为2299.85 ℃、35.46 MPa,其熔化热和汽化热分别为113.5 kJ/kg和4212 kJ/kg,327 ℃时的蒸气压为0.042 mmHg。
钠是优良的导热体和导电体,具有良好的导磁性,同时也具有良好的延展性;钠因其质地柔软可用小刀切割,其新切面有银白色光泽,会在空气中氧化转变为暗灰色,且具有抗腐蚀性。
化学性质
与非金属化合物反应
与水反应
钠的化学性质活泼,在常温或加热时可与水发生爆炸性反应。
与氨气反应
钠与氨气在铁或铁离子的催化下可反应生成氢气,而钠与液态氨作用时不会有氢气放出。 与二氧化碳反应
钠与二氧化碳在350 ℃的温度条件下和赤热的条件下反应分别生成草酸钠和碳酸钠。 与卤化氢反应
钠可与卤素化合物反应生成相应的卤化钠和氢气。
与单质反应
与金属单质反应
钠和铅可在熔融状态下反应生成钠铅合金;
也可在氯乙烷的存在下相互翻译生成氯化钠。
与非金属单质反应
钠的化学性质活泼,在常温或加热时可与氧气化合。
与有机物反应
钠可与低元醇反应产生氢气。
在一定温度条件下,钠可与乙炔反应产生氢气。
同位素
钠的已知同位素有22种,分别为Na-Na,其中唯一稳定存在的同位素为 Na,除此之外其余的同位素都带有放射性。其中Na的半衰期为2.601 9 a,放射性衰变方式(分支比,%):β(89.9),EC(10.1)。
生理功能
促进植物生长
钠是土壤和植物种的重要元素,其含量对于植物的生长具有重要影响。钠是植物生长过程中必须的营养元素,适当适量的对植物施钠可明显提高植物产量,且钠含量过高会影响土壤碱化,抑制植物生长。 钠元素对于部分农业作物的生长是有益的,可以起替代钾元素的功能,当钾元素营养供给不足时,适当提高钠的可以明显促进植物的生长,提高作物产量。对于部分具有C4光合途径和景天酸代谢(CAM)途径的植物种类,磷酸烯醇式丙酮酸的再生、叶绿素合成、丙酮酸盐(或酯)通过叶绿体被膜的运移等都需要钠的参加,施钠能够刺激这些植物的生长。 钠在调节细胞渗透压方面比钾的作用更明显,对许多盐土植物都有明显的生长效应。
钠可调节保卫细胞运动,作为长距离运输的反向离子,参与光电合成等。另外,某些盐生植物的特殊酶类也需要Na,但在细胞质中,许多酶的活性能被K激活,而被Na抑制。
维持生命活动
钠是人体必不可少的常量元素,具有调节体内水分、维持酸碱平衡和血压正常、增加神经肌肉兴奋性和组成钠泵等生理功能。钠广泛存在于细胞外液中和细胞内液的钾共同维持着细胞内外体液的渗透压平衡;钠可以参与肌肉收缩、神经传导、碳水化合物的吸收等生理活动,协助神经系统和肌肉的正常运作;钠还可以使钙或其他矿物质在血液中正常溶解。 钠有维持血压的功能。钠调节细胞外液,构成细胞外液渗透压,细胞外液钠浓度的持续变化对血压有很大影响。 钠有调节水分的功能。钠是维持体内水量的恒定主要元素,钠的含量直接决定谁的含量,所以摄人过多的食盐,则会发生水肿;过少则会易引起脱水。
钠有对ATP的生成和利用的作用,因此钠的含量对肌肉运动、心血管功能及能量代谢都有影响。钠不足时ATP的生成和利用减少,能量的生成和利用较差,会使神经肌肉传导迟钝,出现肌无力、神志模糊甚至昏迷或出现心血管功能受抑制的症状。
钠有维持酸碱平衡的作用。钠在肾脏被重吸收后,与氢离子交换,可清除体内的二氧化碳,保持体液的酸碱度恒定。肾对钠的主动重吸收,引起氯的被动重吸收,有利于胃酸的形成,帮助消化。 制备方法
食盐熔融电解法
通过电解熔融氯化钠可以制备金属钠,其原理如下:
在电解过程中加入氯化钙可以使氯化钠的熔点降低到600 ℃,防止钠挥发和促使生成的金属钠在熔融物质中上浮,避免其分布在熔融盐中,降低产率。 电解烧碱法
该方法以烧碱为原料,加入硝酸钠、硫调色剂等,以铁为阳极,铜为阴极电解制备金属钠。 锆还原制备法
将原料钼酸钠和锆粉按照一定的化学比例均匀混合,并压成棒状,在石英管中加热并抽至真空加热至一定温度,即可发生反应,金属钠会凝附在石英管的内壁。
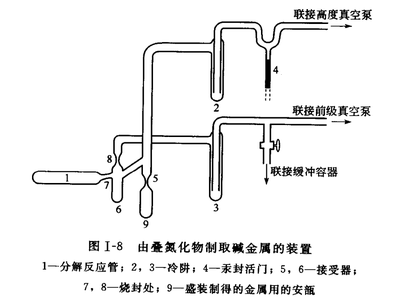
碱金属的叠氮化物高温分解制备法
以叠氮化钠为原料在真空高温的条件下加热分解,即可制备较纯且不含杂质气体的金属钠。其反应原理如下: 检测方法
可采用高氯酸标准溶液滴定法来测定有机酸碱金属盐类物质的含量。以有机碱羧甲基纤维素钠为例,采用冰醋酸作为酸性溶剂,增强其相对碱度,便于强酸性的高氯酸滴定,同时加入一定量的乙酸酐去除水分,以结晶紫为指示剂、高氯酸标准溶液-冰醋酸作为滴定剂,即可测定钠的含量,滴定至溶液显蓝绿色即为滴定终点。 应用领域
化工生产
钠可作为许多化工产品的基础原料,如氨钠法制备的氰化钠、置换氧化钾制备金属钾、还原四氯化钛生产海绵钛。同时还可以作为许多产品的中间体,如氨基钠作为染料靛蓝粉中间体、硼氢化钠、原甲酸三甲酯和甲酸三乙酯等的医药中间体。 照明行业
钠灯是一种气体放电灯,在防腐蚀的玻璃外壳内两端装有电极,抽至真空后加入一定量的钠,通电后钠蒸发,受电子激发的影响即可发出黄光。按照钠蒸气压力的高低可分为低压钠灯和高压钠灯,高压钠灯具有耗电少、寿命长和可以良好的穿透雾气等优点,是机场、码头和高速公路等场所的必要设备。 医药行业
钠可作为制造西力生、维生素和咖啡因等医药产品的制作原料。 钠离子电池
与锂离子电池类似,钠离子电池通过正电荷电子在电极之间的穿梭运动而放电。与锂离子电池相比,钠离子电池可用性更高且成本更低,但钠离子电池较为适用于固定应用场景。钠离子电池属于新一代的化学能源,钠资源丰富,成本低廉分布广泛,具有更高的半电池点位和更加稳定的电化学性能,具有更高的安全性。 钠离子电池的质量重,适用于大型设备能量存储,因此可应用于工业、航天、军事等能量存储领域。钠离子低成本,更使得钠离子电池有望在智能电网及可再生能源的大规模储能中实现广泛的应用。 钢件猝火
熔融钠的冷却能力强。液态钠的温度范围较广,复合钢铁零件热处理所需温度范围,可根据热处理要求适当的选择熔融钠的温度。熔融钠主要用于钢件淬火后的回火,也可用于后续热处理加热,具有热导率高、传热系数高和粘度低等优点。 安全事宜
健康危害
体内缺乏钠会造成生长缓慢、食欲不振、体重减轻、肌肉痉挛、呕吐腹泻、头痛等症状;若乳母体内缺乏钠,则会出现乳汁分泌不足的症状。长期不食用加食盐的食物或经常出现出汗、呕吐、腹泻,都会出现钠缺乏症。 体内钠过量会破坏体液、血液的平衡,造成体液和血液的酸碱度失调,同时还会导致高血压以及肾脏负担过重而引发的肾脏疾病。
钠失衡的改善措施
当体内钠含量过低,可通过饮用淡盐开水和适当的食用富含钠的食物,如豆类红豆、水果类香蕉和巧克力等。
当体内钠含量过高时,对于高血压患者的初期钠过高可以注意饮食以少量钠为主,并通过运动、睡眠来调整;对于潴钠性高钠血症,可通过速尿、利尿酸钠等促使钠、水由肾排出;对于浓缩性高血钠,建议科学地补充水分,并采取措施制止水分继续丢失,以使过高血渗透压得以下降。 泄露应急处理
消防安全
钠在遇水或暴露在潮湿空气中会发热,且极易引起燃烧或爆炸;与碘或乙炔反应剧烈,极易引起燃烧或爆炸。在一定温度下遇四氯化碳在会发生爆炸。
对于有关钠的火灾消防处理,可以采用干沙或干粉进行灭火如干燥氯化钠粉末、干燥石墨粉、碳酸钠干粉、碳酸钙干粉、干沙等灭火。禁止使用水、泡沫、二氧化碳等灭火剂进行灭火。 储存
钠在空气中容易氧化,通常保存在煤油中。储存于阴凉、干燥、通风良好的专用库房内,远离火种、热源。钠需密封包装,不可与空气接触,应与氧化剂、酸类、卤素等分开存放,禁止混存。库房应采用防爆型照明、通风设施,同时禁止采用易产生火花的机械设备和工具,储区应备有合适的材料收容泄漏物。。