光合磷酸化与电子传递的偶联关系
三种光合磷酸化作用都与电子传递相偶联。如果在叶绿体体系中加入电子传递抑制剂,那么光合磷酸化就会停止;同样,在偶联磷酸化时,电子传递则会加快,所以在体系中加入磷酸化底物会促进电子的传递和氧的释放。 磷酸化和电子传递的关系可用ATP/e2-或P/O来表示。ATP/e2-表示每对电子通过光合电子传递链而形成的ATP分子数;P/O表示光反应中每释放1个氧原子所能形成的ATP分子数。比值越大,表示磷酸化与电子传递偶联越紧密。从图4-15或(4-27)式看,经非环式电子传递时分解2分子H2O,放1 个O2与传递2对电子,使类囊体膜腔内增加8个H(放氧复合体处放4个H,PQH2与Cytb6/f间的电子传递时放4个H),如按8个H形成3个ATP算,即传递2对电子放1个O,能形成3个ATP,即ATP/e2或P/O理论值应为1.5,而实测值是在0.9~1.3之间。 化学渗透学说
关于光合磷酸化的机理有多种学说,如中间产物学说、变构学说、化学渗透学说等,其中被广泛接受的是化学渗透学说。 化学渗透学说(chemiosmotic theory)由英国的米切尔(Mitchell,1961)提出,该学说假设能量转换和偶联机构具有以下特点:①由磷脂和蛋白多肽构成的膜对离子和质子的透过具有选择性 ②具有氧化还原电位的电子传递体不匀称地嵌合在膜内。③膜上有偶联电子传递的质子转移系统。④膜上有转移质子的ATP酶。在解释光合磷酸化机理时,该学说强调:光合电子传递链的电子传递会伴随膜内外两侧产生质子动力(proton motive force,pmf),并由质子动力推动ATP的合成。许多实验都证实了这一学说的正确性。 (1)化学渗透学说的实验证据
①阶段光合磷酸化实验
指光合磷酸化可以相对分成照光阶段和暗阶段来进行,照光不向叶绿体悬浮液中加磷酸化底物,而断光时再加入底物能形成ATP的实验。1962年,中国的沈允钢等人,用此实验探测到光合磷酸化高能态(Z*)的存在。1963年贾格道夫(Jagendorf)等也观察到了光合磷酸化高能态的存在。起初认为Z*是一种化学物质,以此提出了光合磷酸化中间物学说。现在知道高能态即为膜内外的H+电化学势。所谓两阶段光合磷酸化,其实质是光下类囊体膜上进行电子传递产生了跨膜的H+电化学势,暗中利用H+电化学势将加入的ADP与Pi合成ATP。 ②酸-碱磷酸化实验
贾格道夫等(1963)在暗中把叶绿体的类囊体放在pH4的弱酸性溶液中平衡,让类囊体膜腔的pH下降至4(图4-16A),然后加进pH8和含有ADP和Pi的缓冲溶液(图4-16B),这样瞬间的pH变化使得类囊体膜内外之间产生一个H+梯度。这个H+梯度能使ADP与Pi生成ATP,而这时并不照光,也没有电子传递。这种驱动ATP合成的类囊体内外的pH差在活体中正是由光合电子传递和H+转运所形成的。这一酸-碱磷酸化实验给化学渗透假说以最重要的支持证据。 ③光下类囊体吸收质子的实验
对无pH缓冲液的叶绿体悬浮液照光,用pH计可测到悬浮液的pH升高。这是由于光合电子传递引起了悬浮液中质子向类囊体膜腔运输,使得膜内H+浓度高而膜外较低的缘故。电子传递产生了质子梯度后,质子就有反向跨膜转移的趋向,质子反向转移时,质子梯度所贮藏的能量就被用去合成ATP(图4-15)。 以上实验都证实了米切尔的化学渗透学说的正确性,因而米切尔获得了1978年度的诺贝尔化学奖。 (2)H+电化学势与质子动力
e-传递与H+向膜内的运转,还会引起类囊体膜的电势变化,使膜外侧带负电荷,膜内侧带正电荷,从而产生H+电化学势差(ΔμH+):
ΔμH+=μH+内 -μH+外
=RT(ln [H+内] -ln [H+外])+F(E内-E外)
=RTln([H+内]/ [H+外])+FΔE
=2.3RTΔpH+FΔE (4-30)
式中R-气体常数(8.314J·mol-1·K-1),T-绝对温度(K),F-法拉第常数(96.5kJ·mol-1·V-1),ΔE-膜电势(V)。 25℃时,ΔμH+ =5.7ΔpH(kJ·mol-1)+96.5ΔE(kJ·mol-1) (4-31)
上式(4-31)中5.7ΔpH(kJ·mol-1)为膜内外质子浓度差所具有的能量,而96.5ΔE(kJ·mol-1)为膜电势所具有的能量。
将式4-31两边用F(96.5kJ·mol-1·V-1)除,规定△μH+/F为质子动力,其单位为电势(V)。
在25℃时:pmf=0.059ΔpH+ΔE
叶绿体类囊体膜的质子动力大部分是来自ΔpH部分,电荷分布所产生的ΔE的贡献很小,原因是其它离子,如Cl-、K+或Mg2+也能穿透类囊体膜,当H+穿透类囊体膜时,Cl-可以与H+同向穿透,或Mg2+ 与H+(1Mg2+/2H+)反向穿透,这样就保持了电中性,结果不产生电势差。 ATP合成的部位——ATP酶
质子反向转移和合成ATP是在ATP酶(腺苷三磷酸酶 adenosine triphosphatase,ATPase)上进行的。叶绿体内囊体膜上的ATP酶也称偶联因子(coupling factor)或CF1-CF0复合体。叶绿体的ATP酶与线粒体、细菌膜上的ATP酶结构十分相似,都由两个蛋白复合体组成:一个是突出于膜表面的亲水性的“CF1”;另一个是埋置于膜中的疏水性的“CF0”。ATP酶由九种亚基组成,分子量为550 000左右,催化的反应为磷酸酐键的形成,即把ADP和Pi合成ATP。另外ATP酶还可以催化逆反应,即水解ATP,并偶联H+向类囊体膜内运输。 CF1的分子量约400 000,它含有α(60 000),β(56 000),γ(39 000),δ(19 000)和ε(14 000)的5种亚基。其中α亚基有结合核苷酸的部位,在进行催化时可能发生构象变化;β亚基是合成和水解ATP分子的催化位置;γ亚基控制质子的穿流;δ亚基也许与CF0的结合有关;ε亚基似乎能抑制CF1-CF0复合体在暗中的活性,防止ATP的水解。δ和ε亚基还有阻塞经CF0的质子泄漏的作用。 CF0含有四个亚基:Ⅰ、Ⅱ、Ⅲ和Ⅳ。Ⅲ是多聚体,可能含有12个多肽,总分子量为100 000。Ⅲ可能是CF0中质子转移的主要通道,而Ⅰ、Ⅱ、Ⅳ亚基的功能可能与建立质子转移通道或与结合CF1有关。 当类囊体膜失去CF1后,就失去磷酸化功能,如果重新加进CF1即可恢复磷酸化功能。失去了CF1的类囊体膜会泄漏质子。但是一旦将CF1加回到膜上或是加进CF0的抑制剂后,质子泄漏就停止了。这表明CF0是质子的“通道”,供应质子给CF1去合成ATP。至于CF1如何利用H+越膜所释放的能量来合成ATP,美国的鲍易尔(Boyer 1993)认为,是H+浓度递度引起CF1上亚基的转动变构而催化ATP合成的。
ATP合成的结合转化机制
γ-亚基的转动引起β亚基的构象依紧绷(T)、松弛(L)和开放(O)的顺序变化,完成ADP和Pi的结合、 ATP的 形成以及ATP的释放三个过程
光合磷酸化的抑制剂
叶绿体进行光合磷酸化,必须:(1)类囊体膜上进行电子传递;(2)类囊体膜内外有质子梯度;(3)有活性的ATP酶。破坏这三个条件之一的试剂都能使光合磷酸化中止,这些试剂也就成了光合磷酸化的抑制剂。
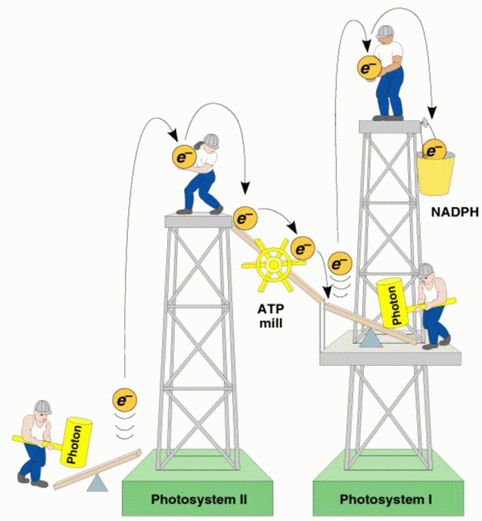
传递过程是:P680→pheo→Q→PQ→Fe-S-Cytb6→Cytf→PC→P700。其中 P700 和 P680
分别为光系统Ⅰ和光系统Ⅱ的作用中心色素,pheo为去镁叶绿素 (2)电子传递抑制剂
指抑制光合电子传递的试剂,如羟胺(NH2OH)切断水到PSⅡ的电子流,DCMU抑制从PSⅡ上的Q到PQ的电子传递;KCN和Hg等则抑制PC的氧化。一些除草剂如西玛津(simazine)、阿特拉津(atrazine)、除草定(bromacil)、异草定(isocil)等也是电子传递抑制剂,它们通过阻断电子传递抑制光合作用来杀死植物。 指解除磷酸化反应与电子传递之间偶联的试剂。常见的这类试剂有DNP(dinitrophenol,二硝基酚)、CCCP(carbonyl cyanide-3-chlorophenyl hydrazone,羰基氰-3-氯苯腙)、短杆菌肽D、尼日利亚菌素、NH等,这些试剂可以增加类囊体膜对质子的透性或增加偶联因子渗漏质子的能力,其结果是消除了跨膜的H+电化学势,而电子传递仍可进行,甚至速度更快(因为消除了内部高H+浓度对电子传递的抑制),但磷酸化作用不再进行。 (4)能量传递抑制剂
指直接作用ATP酶抑制磷酸化作用的试剂,如二环己基碳二亚胺(DCCD)、对氯汞基苯(PCMB)作用于CF1,寡霉素作用于CF(CF 下标的o就是表明其对寡霉素oligomycin敏感)。它们都抑制了ATP酶活性从而阻断光合磷酸化。 叶绿体电子传递链的抑制剂作用位点