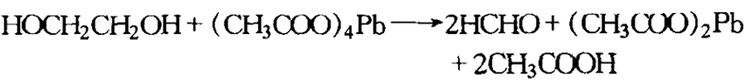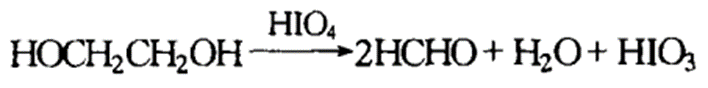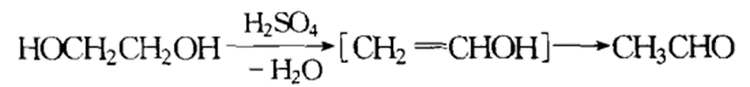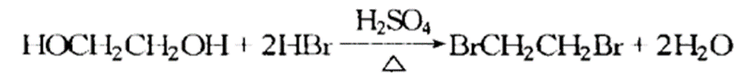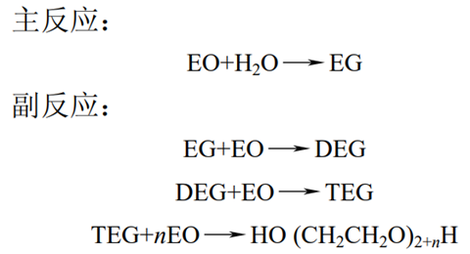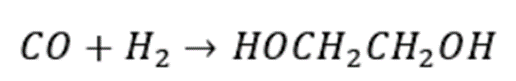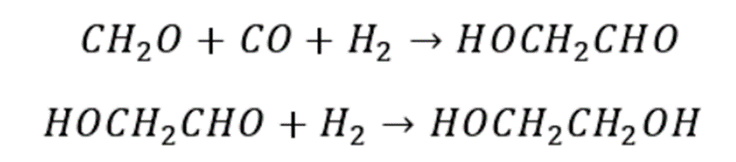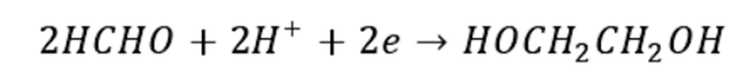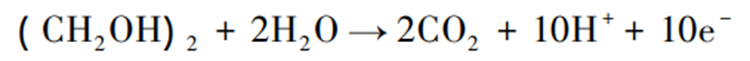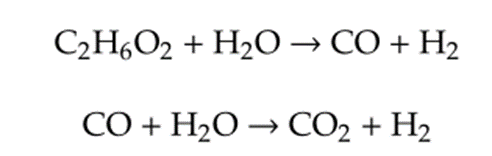乙二醇
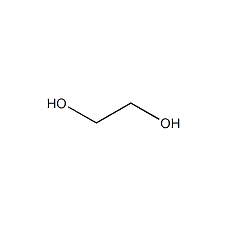
乙二醇结构式
乙二醇(Ethylene Glycol,简称EG),又被称作甘醇或1,2-亚乙基二醇,其化学式为C₂H₆O₂,是最简单的脂肪族二元醇。常温下,乙二醇是一种无色、无臭、有甜味的粘稠状液体,其分子中含有两个羟基分别连接在两个碳原子上。乙二醇的分子量为62.07,熔点-13 °C,沸点197.3 °C(760 mm Hg),密度1.1135 g/mL(20 °C)。乙二醇具有沸点高、凝固点低和还原性弱等特点,能以任意比例与水相混溶,微溶于乙醚。乙二醇化学性质活泼,可发生氧化、酯化、缩聚和脱水等一系列反应,是一种重要的有机化工原料及中间体,广泛应用于聚酯纤维、塑料、防冻液、精细化学品、纳米粒子制备等领域。乙二醇本身具有较低的毒性,会在人体中产生有毒的代谢物,即便少量摄入也会对人类的中枢神经系统以及各个脏器产生不可逆转的危害。 基本信息
性质
溶解性
与水、低级脂肪族醇、甘油、醋酸、丙酮及类似酮、醛、吡啶及类似的煤焦油碱类混溶;
微溶于乙醚,几乎不溶于苯及其同系物、氯代烃、石油醚和油类。
危险性
NFPA 704
健康危害等级:2(可能导致暂时性行为能力丧失或持续性伤害)
可燃等级:1(点火前预热可燃)
稳定性等级:0(稳定)
发现历史
乙二醇(EG)是最简单的二醇,1859年由法国化学家查尔斯-阿道夫·武茨(charles-adolphe wurtz)通过乙二醇二乙酸酯与氢氧化钾皂化反应首次研制出来。在早期阶段,乙二醇的生产规模非常小,直到第一次世界大战期间,其作为冷却剂和生产炸药中重要的原料而得以快速发展。在一战期间,德国科学家采用二氯乙烷水解法生产乙二醇;20世纪20年代,美国则采用氯乙醇法生产乙二醇;20世纪50年代,以石油为基础的乙烯、环氧乙烷合成乙二醇的技术有了突破,再次提高和促进了乙二醇的生产。随着进一步发展,以乙二醇为原料生产的产品已经涵盖了日常生活的方方面面,特别是在能源、化工、汽车、纺织、运输和制造技术相关的领域有着广泛的应用。 化学结构
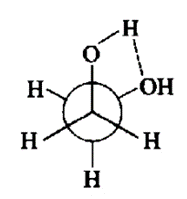
乙二醇的化学式为(CH₂OH)₂,其分子中两个碳原子上各连接着一个羟基。由于碳和氧的电负性不同,得其形成的碳氧键为极性键,因此乙二醇是一个极性分子。乙二醇中的氧是sp₃杂化,两对孤对电子分占两根sp₃杂化轨道,另外两根sp₃杂化轨道一根与氢形成σ键,另一根与碳的sp₃杂化轨道形成σ键。乙二醇的两个羟基基团处于邻交叉构象,这是因为乙二醇分子内形成的氢键可以增加分子的稳定性(氢键的键能大约为21~30 kJ·mol⁻¹),因此乙二醇具有更高的沸点。 理化性质
物理性质
乙二醇是一种具有甜味无色无臭的粘稠液体,故而俗称“甘醇”。其密度为1.1135 g/cm³(20 ℃),沸点197.3 ℃(760 mm Hg),熔点-13 ℃,闪点111 ℃,饱和蒸气压为0.06 mm Hg(20 ℃)在空气中发生自燃的温度为412.8 ℃,爆炸范围为3.2%-15.3%。乙二醇在水和丙酮中有很好的溶解度,能溶于大多数常见溶剂,微溶于乙醚,不溶于石油烃及其油类。当乙二醇被冷却时,其会形成一种高粘性、过冷的物质,最终凝固形成一种类似玻璃的物质。
化学性质
氧化反应
乙二醇可以发生氧化反应,根据所使用的氧化剂不同,乙二醇的氧化产物也会不同。
重铬酸钠(钾)和硫酸氧化法
将乙二醇用重铬酸钠(钾)和硫酸氧化时会生成一系列氧化程度不同的产物,反应如下。用三氧化铬和冰醋酸或高锰酸钾氧化时发生相似反应。 四乙酸铅氧化法
乙二醇用四乙酸铅在醋酸或苯溶液中氧化时,会生成二分子醛或酮,其反应如下:
高碘酸氧化法
乙二醇用高碘酸氧化时也生成二分子醛或酮,其反应如下:
酯化反应
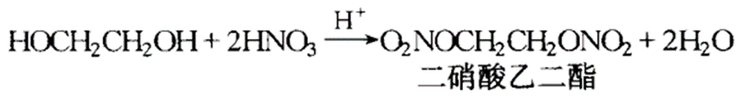
乙二醇可以和含氧无机酸发生酯化反应,例如乙二醇与硝酸反应如下:
缩聚反应
脱水反应
在硫酸条件下,乙二醇能发生脱水反应生成乙醛,其反应如下: 其他反应
与金属反应
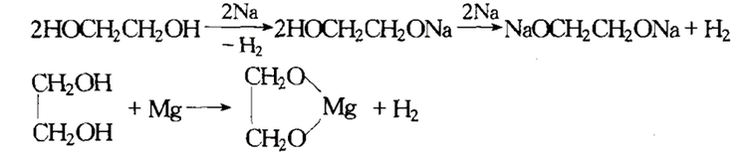
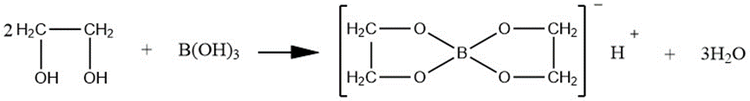
乙二醇能与碱金属发生反应,反应中醇羟基中的氢原子被金属取代,生成氢气。例如乙二醇和金属钠反应如下: 与硼酸反应
乙二醇能与硼酸反应生成螯形化合物,其反应如下:
与氢卤酸反应
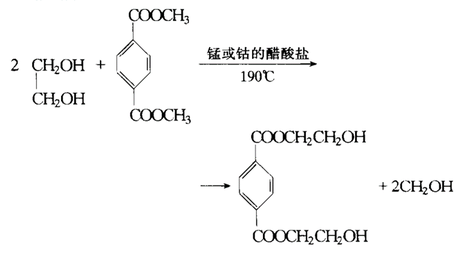
乙二醇可以和氢卤酸发生反应,其中卤素原子会取代羟基基团。例如乙二醇与氢溴酸反应如下: 酯交换反应
乙二醇可以发生酯交换反应,例如:
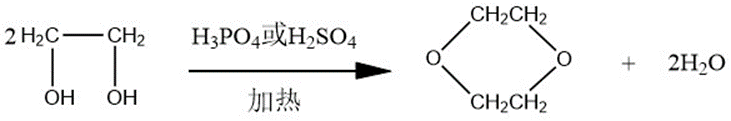
环合反应
在加热条件下,乙二醇在硫酸或磷酸中可以发生环合反应,其反应如下:
制备方法
石油制备路线
环氧乙烷直接水合法
环氧乙烷直接水合法在乙二醇制备工艺中占主导地位,其反应是在高温条件下直接水合生成乙二醇,伴随的副产物有二乙二醇(DEG)、三乙二醇(TEG)等乙二醇同系物。反应式如下:
由于产物中含有副产物二乙二醇、三乙二醇和少量的聚乙二醇,因此为了提高此工艺中乙二醇的选择性,需要在反应中消耗大量的水。由于水量大,故导致乙二醇分离脱水的流程较为复杂。并且此工艺具有流程长、水耗高、分离困难、生产成本高等缺点。 环氧乙烷催化水合法
环氧乙烷催化水合法是在环氧乙烷直接水合法的基础上,加入高效的催化剂,从而提高环氧乙烷的转化率,并提高乙二醇的选择性。催化剂的加入使得此工艺中水的消耗大大降低,减少了能耗并降低了生产成本。
碳酸乙烯酯法
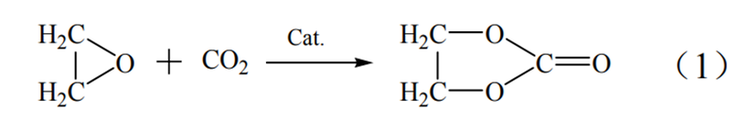
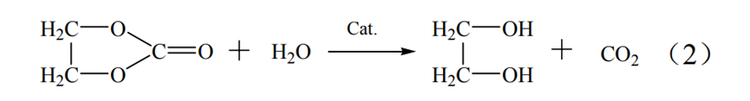
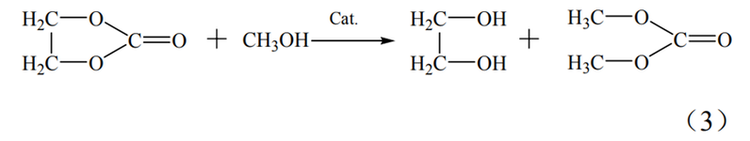
碳酸乙烯酯(EC)合成法制取乙二醇要经历三个步骤。首先要通过乙烯的氧化反应制得环氧乙烷,之后环氧乙烷再与二氧化碳发生反应生成碳酸乙烯酯,最终采用碳酸乙烯酯水解或酯交换的方式制取乙二醇。此方法在合成乙二醇中具有选择性高,收率高和整套工艺绿色环保等优点,在原料、能耗和转化率方面均优于环氧乙烷水合法,但此方法的缺点是其采用的酸性催化剂会造成严重的设备腐蚀。
EC法反应过程如式(1)~式(3)。
煤基制备路线
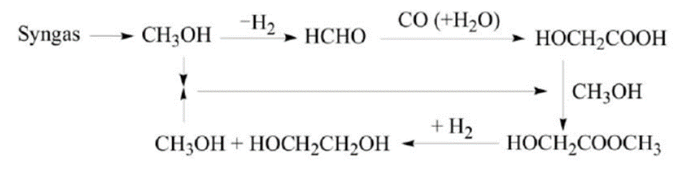
煤制乙二醇工艺包括直接法和间接法,实质上是煤基合成气制乙二醇。直接法生产工艺是将合成气作为原料直接转化得到乙二醇,间接法生产工艺首先利用合成气生成甲醇、甲醛等中间体产物,再通过催化加氢的方法生成乙二醇,而根据中间产物的不同,间接法又被分为甲醛羰基化法、草酸二甲酯加氢法以及甲醛氢甲酰化法等。 直接法
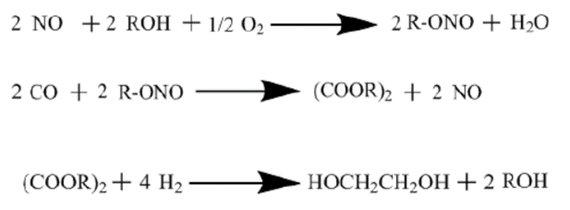
合成气直接法制乙二醇是通过CO和H₂一步直接合成乙二醇的方法,该反应需要在高温、高压和催化剂条件才能进行。其反应方程式如下:
间接法
以甲醇为原料制备乙二醇是在引发剂作用下,甲醇激发产生自由基·CH₂OH,再进行氧化偶联反应制得。反应需要在紫外线照射和有氧条件下经铑或锗催化进行。 甲醛羰基化法制备乙二醇是由合成气制备的甲醛通过与CO羰基化生成乙醇酸,接着乙醇酸和甲醇发生酯化反应生成乙醇酸甲酯,然后乙醇酸甲酯通过加氢进一步生成乙二醇。反应过程如下: 甲醛氢甲酰化法制乙二醇是通过合成气先与甲醛反应生成乙醇醛,随后通过催化加氢生成乙二醇,反应采用钴、铑催化剂。具体反应如下: 甲醛电化学加氢法制乙二醇是通过对低浓度的甲醛与水混合溶液直接进行电解制得。该反应制得的乙二醇收率高,制备条件温和,但是能量消耗大。其反应方程如下:
甲醛缩合法是通过两步反应得到乙二醇。首先以甲醛水溶液为反应液,在碱性催化剂中,以沸石为催化剂,通过自身缩合生成乙醇醛;然后在常压,温度为94 ℃的条件下,采用镍催化剂催化乙醇醛合成乙二醇。 乙二醇还可以通过草酸酯法制备。草酸酯法又叫CO偶联法,由于液相反应对设备腐蚀严重,因此研究人员开发出气相加氢路线。草酸酯气相加氢反应主要分为CO偶联制草酸二甲酯(DMO)和DMO加氢生成乙二醇两个阶段。在CO偶联制DMO阶段,CO和亚硝酸甲酯发生偶联反应生成DMO,接着亚硝酸甲酯通过甲醇和氧气与NO发生反应实现再生,然后进入到第二阶段,即DMO加氢生成乙二醇,具体反应过程如图所示: 生物基制备路线
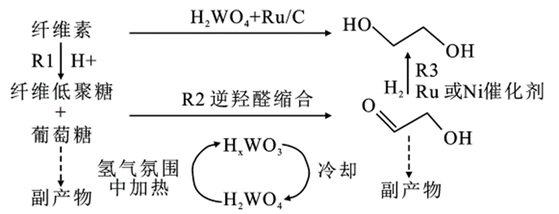
除了煤和石油外,纤维素、糖类、植物秸秆和甘油等也可用于生产乙二醇。并且具有原材料价廉且容易获得的特点。其中纤维素制乙二醇实质是利用水解反应所生成的葡萄糖为原料来制备乙二醇。在反应过程中,含钨催化剂还原为钨青铜,钨青铜溶解在水溶液中,电离产生H⁺,纤维素在H⁺的催化下水解成纤维低聚糖和葡萄糖,并从热水和溶解的钨青铜中释放出来(R1)。低聚糖和葡萄糖一旦形成,在钨青铜催化剂的催化下,经过C—C键的断裂,生成关键中间体乙醇醛(R2)。最后乙醇醛在过渡金属如Ru或Ni的多相催化下迅速氢化成乙二醇(R3)。 应用领域
聚酯工业
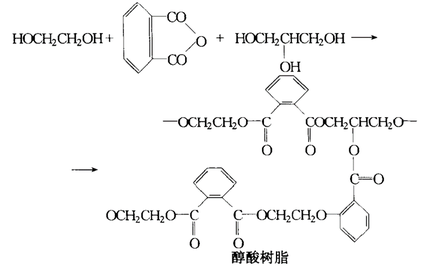
乙二醇可以作为生产聚酯纤维和聚酯塑料的原料,如聚琥珀酸乙烯酯,聚氨酯等;其中最主要的是用于合成聚对苯二甲酸乙二醇酯(PET),PET可作为涤纶纤维、涂料和聚酯塑料的原料。其次,马来酸、富马酸等多元酸与乙二醇反应可制备醇酸树脂。乙二醇的另一项重要应用是用于下游纺织行业生产聚酯纤维(涤纶),此外还可用于生产聚酯薄膜等。 防冻剂、除冰剂
乙二醇的冰点为-13 ℃,且可与水以任意比例互溶,其水溶液的冰点随乙二醇浓度的降低而降低,沸点随之升高,在乙二醇浓度为66%时达最低冰点为-68 ℃,进一步降低乙二醇浓度,混合物冰点反而上升。由于乙二醇由于拥有较低的比热容和传热效率,因此可用作飞机、汽车、仪器仪表的防冻剂和除冰剂等。市场上大多使用的是乙二醇的水基型防冻液。
水合物抑制剂
天然气开采及储运过程中,天然气水合物常常造成管道、阀门和设备等的堵塞,从而影响天然气的开采、集输和加工的正常运转。乙二醇可用于天然气的水合物抑制剂,因为它可以去除水分,并通过降低天然气水合物的形成温度,改变天然气分子和水分子的热力学平衡,来抑制天然气水合物的形成。乙二醇无毒,沸点较高,蒸发损失小,其水溶液的冰点低,不易冻结,因此适用于天然气处理量大的场合,并能在净化处理后重复使用。 燃料电池
乙二醇可作为燃料电池开发中的新型液体燃料。在标准状况下,乙二醇的Gibbs自由能为-1181 kJ·mol⁻¹,比能量为5.27 kW/h·kg⁻¹,电池的理论效率为98.9%,其具有高理论容量(4.8 Ah/m·L⁻¹)、高沸点(198 ℃)以及低挥发性,这使乙二醇作为燃料电池更安全;此外乙二醇还具有较低的燃料渗透率、较高的能量密度和高电能转换率等特点。理论上,1 mol乙二醇分子完全氧化成CO₂会产生10 mol电子,乙二醇电解反应方程式为:
乙二醇燃料电池工作原理为:乙二醇通过电池的阳极进入,在催化剂表面发生氧化反应,产生质子或电子,质子经过离子交换膜传导到阴极,而电子通过外电路到达阴极;在阴极对氧气进行还原生成水,完成氧化还原反应。可用于乙二醇的电化学氧化催化的有Pt基,Pd基,Pt-Ru合金,Pt-Pd合金,Pt-Sn合金电极和薄膜等材料。 制取氢气
乙二醇可以用于制取氢气,是一种可再生的、易获得的能源载体。由于乙二醇是结构最简单的多元醇,且具有所有多元醇类的特征基团,因此是水相重整制氢(APR)的最佳研究模型。在乙二醇水相重整过程的第一步反应中,乙二醇的C-C键和C-H键被打破,形成少量CO和H₂,然后进行水煤气变换(WGS)反应,CO与H₂O反应生成大量H₂和CO₂,反应方程式为: 其他
乙二醇可以作为合成乙二醇醚、乙二醛、乙二酸、羟基乙酸等化工产品的原料,也可用于生产润滑剂、色谱填充剂和染料等。此外,用乙二醇和聚乙二醇能衍生出多种类型表面活性剂,用于增塑剂、干燥剂、柔软剂的生产,乙二醇的二硝基化合物可作为为炸药,乙二醇的甲基、乙基和丁基醚可用作溶剂。此外,乙二醇还广泛应用于制造合成纤维、橡胶、化妆品、聚酯漆、胶粘剂、气相色谱固定液、合成树脂等。 安全事宜
消防相关
乙二醇为可燃物,属于IIIB类可燃液体,闪点为110 ℃,空气中爆炸极限浓度为3.2%~15.3%。若发生乙二醇火灾事故,可使用“酒精”泡沫、干粉或二氧化碳灭火剂处理。乙二醇蒸气密度大于空气,会聚集在通风不良、低洼或密闭区域(例如下水道、地下室和储罐)中,使区域内危险性上升。 乙二醇化学性质活泼,储运时应存放在密闭容器中,置于阴凉、通风良好的区域,远离氧化剂、强酸和强碱,以免发生事故。
健康相关
摄入暴露
乙二醇进入人体后2-4小时会在肝脏和肾脏中代谢,大多数乙二醇及其代谢产物会在24至48小时内排出。在人体中,乙醇脱氢酶促进了新陈代谢,乙二醇被氧化为草酸,并导致各种器官中钙晶体的形成,因此尿液中会含有草酸钙结晶等。此外,乙二醇具有轻微的麻醉作用。 乙二醇急性中毒后,随着时间的增加会产生三个或者四个(较少)临床阶段。第一阶段,在摄入乙二醇后30 min-12 h内,患者可能表现出类似醉酒的症状。第二阶段为在摄入乙二醇后12-72 h发生的心肺毒性阶段,出现的症状包括心动过速、呼吸急促、肺水肿和/或心力衰竭。第三阶段为摄入后24-72 h内,主要由乙二醇的代谢产物乙醇酸和乙醛酸的积累引起严重酸中毒。乙醛酸进一步代谢为草酸,之后形成草酸钙沉淀在肾脏中,造成肾功能衰竭。乙醇酸和乙醛酸与碳酸氢盐反应,导致体液,特别是血液中的pH值降低。其他神经症状-对颅神经的影响。在摄入后6天或更长时间后可能构成第四个临床阶段。神经系统的延迟会导致面瘫、听力丧失、脑脊液中蛋白质水平升高和双侧颅神经功能障碍。其他神经后遗症包括不等视、视力模糊、吞咽困难、呕吐、反射亢进和共济失调。 其他暴露
眼睛接触乙二醇蒸气可能会引起刺激,接触液态乙二醇可能导致眼睑和角膜肿胀、结膜和虹膜肿胀以及结膜或角膜损伤。人体吸入高浓度乙二醇蒸气时会导致粘膜和上呼吸道的刺激。当暴露在高于80 ppm的乙二醇浓度中会导致严重的呼吸不适和咳嗽。此外,乙二醇还对皮肤具有刺激性。 急救措施
眼睛接触:立即远离暴露源,同时用大量温水清洗眼睛至少15分钟(如有隐形眼镜应先取下),并立即就医。
皮肤接触:使用冷水或温水彻底冲洗受影响的皮肤,同时去除并隔离所有受污染的衣物,还可用肥皂水清洗受影响的皮肤区域。如果出现发红或刺激等症状,立即就医。
吸入:立即离开污染区域,并深呼吸新鲜空气。如果出现喘息、咳嗽、呼吸急促或口腔、喉咙或胸部灼热等不适症状,立即就医。
摄入:立即漱口,不要催吐,确保呼吸通畅,立即就医,在医生的指导下治疗,并监测心脏功能,评估低血压、低血糖、心律异常、呼吸功能下降,电解质紊乱等情况。