铁
铁(英文:Iron),一种常见的金属元素,化学符号为Fe,原子系数为26,相对原子质量为55.85,位于元素周期表第四周期第Ⅷ族,价电子层结构为[Ar]3d4s。纯铁通常为银白色或灰色,有一定的韧性和延展性,粉末状的铁是黑到灰色的。铁最高的氧化态为+6,在一些配合化合物中也能呈现其他更低的氧化态,其中以+2,+3价最为常见。铁元素在自然界是广泛存在的,占地壳含量的4.75%,仅次于氧、硅、铝,位于所有元素的第四位。 自然界中游离态的铁只存在于陨石中,地壳中的铁都以化合物的形式分布于各类矿石之中。铁的主要矿石有:赤铁矿(Fe2O3),磁铁矿(Fe3O4),褐铁矿(2Fe2O3·3H_2O)等。铁及其化合物广泛地用于颜料、催化、超导等领域。同时铁也是人体内必须的微量元素之一,在人体内分布很广,几乎所有的人体组织都含有铁。铁是血红蛋白和肌红蛋白的重要组成成分。在血液中氧气的运输和肌肉中氧气的储存都起着重要的作用,也是许多酶的组成成分和氧化还原反应酶的激活剂。 发现、命名及使用
铁矿石是地壳的主要组成部分,所以铁在自然界中的分布是十分广泛的。但是人类发现和使用铁却比黄金和铜迟,这主要是因为天然的纯铁在地球上几乎不存在,不像自然金和自然铜那样容易被人发现。而且铁容易氧化生锈,只有和镍混合的铁才能持久不锈,但是含镍的自然铁又极少。 因地球上很难找到自然铁,人类最早发现铁来源于天空中落下来的陨石,陨石中有些成分是铁镍合金,称为陨铁。埃及或美索不达米亚地区的古文明国家所发现的最早的铁器都是由陨铁加工制成的。在埃及的前王朝时期(公元前3500年),曾用含镍7.5%的陨铁制成铁珠;在埃及十一王朝(公元前2000年)的一个古墓里,出土了含镍0.5%的陨铁制成的镶银辟邪护符。而中国目前发现最早的铁器是甘肃省临潭县磨沟寺洼文化墓葬出土的两个铁条,距今3500年(公元前1500年)左右。由于铁早期特殊的来源方式,古埃及人把铁叫做“天石”,在西亚古苏美尔语中,铁被叫做“安尔巴”,意为“天降之火”。在古代人们发现铁时,由于其坚硬的特性,被命名为“Iron”,该词来源于拉丁语,有“坚固、刚强”之意。铁的元素符号“Fe”,源于拉丁文“Ferrum”,意指“铁”,系该词的缩写。 同时由于陨石的来源稀少,只靠陨石来获得铁难以满足人们生产生活的需求,随着冶炼青铜器技术的逐渐成熟,铁的冶炼技术应运而生。铁的发现和大规模使用,是人类发展史上的一个里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。恩格斯曾经指出铁器的使用在古代人类社会发展史上具有重大意义,认为“铁已经为人类服务,这是在历史上起了革命作用的各种原料当中最后者(直到马铃薯的出现为止)和最重要者”。至今铁仍然是现代化学工业的基础,人类进步所必不可少的金属材料。 分布与开采
全球铁矿资源丰富,分布较为集中。据美国地质调查局数据,2018年全球铁矿储量为1700亿吨,和2017年保持一致;铁金属储量940亿吨,比2017年上升1.2%。其中澳大利亚、巴西、俄罗斯、中国和印度五国铁储量合计占全球的77.5%,巴西、澳大利亚的铁矿资源品质较高,大部分在60%以上;中国以平矿为主,原矿平均品味只有34.5%,低于49.4%的全球平均水平。在矿石的种类上澳大利亚、巴西等国生产的铁矿石多为赤铁矿,由于矿石中有害杂质较少,可直接入高炉,矿石烧结、冶炼性能都比较好;而中国的铁矿石又多为含铁品味较低的磁铁矿石,需要提纯烧结制球后才能入炉,使得生产成本相对较高。 随着开采技术的不断提升和生产需求的不断提高,近年来全球铁矿石的开采量稳步增长,2021年全球铁矿石产量达26亿吨,较2020年增加了1.3亿吨,同比增长了5.26%。全球高品位易开采的铁矿资源主要分布在澳大利亚、巴西、中国、印度、俄罗斯等国,因此澳大利亚、巴西、中国、印度、俄罗斯也成为全球铁矿石重要的生产国,2021年澳大利亚铁矿石产量完成9.00亿吨,占全球铁矿石总产量的34.6%,全球排名第一。这些铁矿石在开采后,经过破碎、筛分、球磨等步骤后多直接用于生铁冶炼,并进一步生产粗钢和钢材等产品。 理化性质
物理性质
铁是一种银白色或灰色的金属,纯铁质地柔软,密度为7.87g/cm,熔点为1538 ℃(1atm),沸点为2861 ℃(1atm),通常不溶于水和碱,溶于酸,有良好的延展性和导热导电性能。铁和铁的合金有很强的铁磁性,属于磁性材料。室温下铁是体心立方结构,发生相变时也有面心立方结构的铁存在,在干燥的空气中铁是很稳定的。将铁和其他金属元素合金化能增大铁的硬度,降低熔点,甚至有的能解决铁的生锈问题。 同素异形体
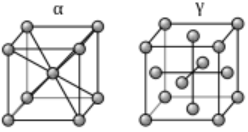
大多数金属在结晶完成的后续冷却过程中,其晶体结构就不发生变化,即固态时只有一种晶格,如铜、铝等。而铁在固态下随着温度的改变,会由一种晶格转变为另一种晶格,这种现象称为同素异构转变。
铁在912 ℃以下为体心立方结构,称为α-Fe,与碳的固溶体称为α铁素体;在912 ℃-1394 ℃时转变为面心立方结构,称为γ-Fe,与碳的固溶体称为奥氏体;温度在1394 ℃至熔点间又变为体心立方结构,称为δ-Fe,与碳的固溶体称为δ铁素体。纯铁在发生同素异构转变时,其体积和力学性能也随之发生改变。正因为如此,生产中才有可能对铁碳合金等进行热处理,以改变其性能。 同位素
铁有四个稳定的同位素,按照自然丰度由低到高分别为:Fe、Fe、Fe 和Fe,具体数值如下图表格所示。此外铁还有一些放射性同位素,例如Fe、Fe等,它们的半衰期分别为2.7年和44.5天。由于相对于H、O、S等轻元素而言,Fe同位素间的相对质量差较小,受到测试技术的制约,传统的质谱技术无法将之分辨出来。直至多接收器等离子体质谱仪(MC-ICP-MS)的出现和发展,使得高精度测量Fe等金属同位素的组成成了现实。同时为了将Fe同位素与H、O、S等轻元素稳定同位素相区别,将Fe、Cu等过渡族元素的同位素称之为重元素稳定同位素或非传统稳定同位素。 元素符号 | 原子序数 | 质量数 | 中子数 | 同位素 | 原子质量数 | 同位素丰度(%) | 原子质量 |
Fe | 26 | 54 | 28 | Fe | 53.93961 | 5.84 | 55.847 |
56 | 30 | Fe | 55.93494 | 91.76 |
57 | 31 | Fe | 56.93540 | 2.12 |
58 | 32 | Fe | 57.93328 | 0.28 |
铁稳定同位素的参数
化学性质
铁和钴镍类似都是中等活泼的金属。在没有水汽存在时,一般温度下,和氧、硫、氯和磷等非金属几乎不起作用,但在高温下可以发生猛烈反应。铁与氮虽然不直接化合,但却与氨作用形成Fe2N。此外碳溶解在熔融的铁中形成 Fe3C。
铁是一种变价金属,最高的氧化态为+6,其他氧化态有+5、+4、+3、+2和0,在某些配合物中,也呈现更低的氧化态。铁常见的氧化态是+2和+3,其中+3价的铁有很强的氧化作用,高价态的铁通常都是以高铁酸盐或配合物等形式存在。 在酸性溶液中,Fe 是铁的最稳定状态,高氧化态的铁在酸性溶液中是很强的氧化剂。空气中的氧气能将酸性溶液中的Fe氧化为Fe。铁和盐酸作用生产FeCl2,但在干态,因为Fe的第三电离势较小,Fe和氯气反应产物是FeCl3。当铁和热的稀硝酸反应则有一部分 Fe 由 Fe氧化为 Fe。所以浓硝酸或含有重铬酸盐的酸可以使铁钝化,生成一层致密的氧化膜。碱性介质中,铁最稳定的氧化态是+3,在碱性介质中将低氧化态的铁氧化为高氧化态比在酸性介质中容易。例如,向含有的溶液中加入强碱,能生产白色 Fe(OH)2 沉淀,但在空气中的氧气又立刻把白色 Fe(OH)2 氧化成红棕色 Fe(OH)3。 铁与非氧化性稀酸反应:Fe+2H = Fe+H2↑
3Fe + 4H2SO4(浓) = Fe3O4 + 4SO2↑ + 4H2O
3Fe + 8HNO3(浓) = Fe3O4 + 8NO2↑ + 4H2O
将水蒸气通过烧热的铁,可以得到H2和 Fe3O4:
3Fe + 4H2O = Fe3O4 + 4H2↑
向亚铁离子中加入强碱,先生成白色沉淀,后又被空气氧化成红棕色: Fe + 2OH = Fe(OH)2↓
4Fe(OH)2 +O2 + 2H2O = 4Fe(OH)3↓
制备方法
工业制法
铁矿石中的铁,一般呈氧化物状态,如赤铁矿(Fe2O3)、磁铁矿(Fe3O4)、褐铁矿(含结晶水的 Fe2O3)、菱铁矿(FeCO3热分解后成为FeO)等。约在500℃-600℃左右,铁矿石中的氧化铁与还原剂(木炭及其他燃烧物所产生的一氧化碳)接触时,便可逐渐还原成铁,到1000 ℃左右才能得到含碳量很低的固体黑块。 炼铁反应方程式,以磁铁矿为例:
4CO + Fe3O4 = 3Fe + 4CO2↑
这种炼铁技术,曾被称为“块炼法”或“低温固体还原法”,其产品通常被称为“块炼铁”或“海绵铁”。这样的炼铁法,产量低、劳动强度大、浪费原料多,且产品不够坚固耐用。 实验室制法
实验室制铁可以通过铝热法炼铁,在高温条件下利用金属铝还原氧化铁可以得到铁,反应方程式如下所示: 高温条件下,氢气和氧化铁反应可以制取纯度较高的铁,反应方程式如下:
工业上也叫这种方法为直接还原炼铁工艺,与工业制铁的高炉炼铁相比,直接还原炼铁工艺可以摆脱对焦煤资源的依赖,并减少二氧化碳的排放,而且直接还原铁在元素纯净性方面有天然的优势,是生产高品质钢铁产品的优质原料。 此外还可以通过羰基合铁热分解来得到纯铁。羰基合铁在300℃时可以分解为铁和一氧化碳,但是由于这个反应通常引入氨气为保护气,会导致制得的铁粉中不可避免的有氮元素存在,后续可用氢气还原进一步提高铁的纯度。 应用领域
颜料
氧化铁是一种多用途的黑色颜料,具有良好的耐候性、耐碱性和耐光性,因而在建筑行业的地面、墙壁、人造大理石和混凝土等领域广泛用作涂料和着色剂,在混凝土中的用量可达5%-8%。防锈性能好、防腐蚀佳、遮盖力和着色力强,与涂料其它成分的相容性好,能吸收紫外线,广泛用于各种户外用漆、交通用漆、金属防锈底漆及面漆中,若进行超细处理制成透明铁黑,还适用于汽车面漆、木材着色、光头涂料和医药包装器着色。 污染物降解
纳米零价铁是一种绿色原位的新兴环境友好型材料。多年来的研究表明,纳米零价铁对重金属、有机染料、药品及有机氯化物等均有较高的去除效果,作为环境纳米材料在地下水污染修复领域中已被广泛应用。纳米零价铁通常是通过吸附、离子交换、氧化还原、共沉淀、络合等反应来达到去除污染物的作用。南开大学展思辉团队利用氮空位调节铁单原子局部电子密度实现高效光分顿过程,他们将单个铁原子分散在具有丰富氮空位的氮化碳上并在可见光照射下激活过氧化氢,且优化后的材料展现出高的环丙沙星降解活性,是原来氮化碳的18倍。 催化剂
费托合成可以高效将煤、天然气和生物质等转化为液体燃料和高价值化学品。与常规的贵金属钌或铂基催化剂相比,铁基催化剂因其价格低廉,产物分布广而被广泛研究。中国科学院大连化学物理研究所的包信和研究组设计了一种将铁纳米粒子封装于碳纳米管中的纳米材料,并发现这种材料有出色的催化一氧化碳加氢反应的活性。除此之外,单原子铁基催化剂在氧还原反应中已经展现出了超过贵金属铂的催化活性;来自马里兰大学和罗切斯特大学的研究者们开发了一种通用的铁催化多组分环化-交叉偶联方案,该方案适用于广泛应用于各种烷基或杂环取代烯烃的功能化和生物活性分子的后期功能化,且催化反应产率高、区域选择性好。将来有可能应用药物、材料和农药的合成领域。 铁基超导
超导现象自发现以来已有一百多年的历史,是凝聚态物理中的一个重要分支,蕴含着巨大的应用前景。最早是在2006年,日本东京工业大学的Hosono研究组发现在氟掺杂的LaFeAsO体系中存在高达26 K的超导转变。由于铁离子带有磁性,会破坏超导,因此在含铁的化合物里找到了超导电性突破了人们的认知。中国科学院电工研究所的研究人员通过对铁基超导线材制备工程中涉及的相组分与微结构控制、界面复合体均匀加工等关键技术的系统研究,解决了铁基超导线规模化制备中的均性、稳定性和重复性等技术难点,并于2016年成功制备出长度达到115 m的铁基超导线材,这项工作被认为是铁基超导材料从实验室研究走向产业化进程的里程碑,奠定了铁基超导材料在工业、医学、国防等诸多领域的应用基础。 铁合金
铁是最重要的基本结构材料,由铁为原料制取的铁合金在工业上多种领域应用广泛。[20]以硅铁合金为例,硅铁合金是以焦炭、钢屑、石英为原料,用电炉冶炼制成的。硅和氧很容易化合成二氧化硅,所以硅铁常用于炼钢过程中的脱氧剂,同时由于二氧化硅生成时放出大量的热,所以在脱氧的同时也能提高钢水的温度。硅铁合金广泛用于低合金结构钢、弹簧钢、轴承钢、耐热钢及电工硅钢之中。 土壤修复
土壤污染物涉及面广,治理难度大,具有隐蔽性、滞后性,因此土壤污染及其修复技术的研究具有很强的现实意义和远期价值。纳米零价铁原位还原修复技术属于原位还原法的范畴,具有设备简单、实施成本低、适用的污染物范围广、修复速度快、效率高、适用深度大等优点。
铁与健康
缺铁是困扰全球的微量营养素缺乏问题,当前全球面临缺铁困扰的人多达数亿。缺铁导致人体疲劳、虚弱、劳动能力下降,尤其对孕妇和学龄前儿童的生长发育带来严重影响,此外还有多达一半的贫血是由缺铁造成的。缺铁现象的存在一直对世界各地人民的健康生活造成严重挑战。中国政府一直高度重视此类问题,一直致力于将铁等微量营养元素引入食物中。上世纪90年代的多项研究数据表明中国农村6个月婴儿贫血率高达50%,育龄妇女的贫血率为41.1%。到了2002年全国营养调查结果显示中国人群贫血率为20.1%,到了2010-2013年全国营养监测显示中国6岁以上人群贫血率降低到了9.7%。据卫健委2020年发布的《中国居民营养与慢性病状况报告》显示,这一数据在2015-2019年为6.1%。 虽然外源补铁被认为是预防和改善缺铁的有效途径,然而铁极易诱导氧化应激,补铁可能会使动物机体出现副作用,长时间或高剂量的补铁能够导致机体沉积过量的铁并诱导多种疾病。例如,铁代谢调控蛋白相关基因的突变或其它疾病容易导致肠道无限制地吸收铁,诱导机体出现铁过载及相关疾病。有研究表明,服用铁制剂胶囊过量的患者胃肠道粘膜有大量铁沉积现象,胃肠道出现侵蚀性损伤。