在化学实践中, 经常需要讨论元素金属性或非金属性强弱的问题。我们衡量的标准是:对金属元素而言,常依据它失电子能力的强弱,失电子能力强者则金属性强, 反之则弱。显然, 这只是定性的判断, 那么, 在化学中定量的判断是什么呢? 由此,随之产生了元素的电离能、电子亲合能、电负性和电极电势四个概念。本文将讨论四者的联系与区别及作为定量判断标准的依据。 原子性质
根据电离能和电子亲合能的概念, 先讨论元素游离态的原子的性质。化学工作者发现气态氢原子的1S 电子,若得到13.6ev 的能量, 将从基态跃迁到n=∞的高能级, 成为自由电子;氢原子失去一个电子变为正一价的气态阳离子, 我们说氢的电离能(I1)为13.6ev 。又如典型碱金属Na 的电离能为5 .139ev(I1),表示只需5 .139ev 的能量,Na原子将失去最外层的一个电子,变成金属阳离子。而5.139ev <13.6ev,可见Na 金属性很强。相应的非金属元素, 如氟的第1电离能为17.422ev ,比氢I1还要大,且远比Na 的I1大,足以说明氟不可能显金属性,那么它的非金属性有多强呢? 查表知氟的电子亲合能为327.9kJ .mol ,表示氟原子加合一个电子时,要放出327.9kJ.mol的能量, 即它得电子的能力很强,是典型的非金属性元素。上面只是考察元素游离态原子的非金属性与金属性,但在化学实践中,更多的要讨论在分子环境中原子吸引电子能力的强弱, 这时就要用到电负性的概念。这个统一的标准可以把金属元素与非金属元素放到一起, 综合考察它们的性质及在元素周期表中的递变规律。前面提到的Na ,它的电负性为0 .9,而F 的电负性为4 .0,是所有元素中最大的,当然也是非金属性最强的元素。又据鲍林标度大体规律, 金属元素的电负性在~2.0以下,非金属元素的电负性在~2.0以上。这样判断元素的这两种性质有了统一尺度, 而且两种不同元素间也有分界。 由此可见, 元素的金属性和非金属性与上述三者性质紧密结合在一起了。元素的电离能、电子亲合能、电负性作为判断元素金属性与非金属性的定量尺度发挥着重要作用。然而,上面是讨论的气态环境中元素的有关性质。那么,在水溶液中性质也相似吗?化学理论产生于化学实践。为了度量元素在水溶液中金属性与非金属性强弱, 我们又引入了元素电极电势的概念。对于金属元素, 如铜半电池的标准电极电势为+0.3419 V ,锌半池的标准电极势为-0 .7618V ,显然0.3419>(-0.7618 V),即锌比铜金属性强。锌的电极电势比铜的电极电势小得多,金属锌是较强的还原剂,而锌离子能在溶液中较稳定地存在, 是弱氧化剂。相反, Cu 是比Zn较强的氧化剂,而金属铜是比金属锌更弱的还原剂。这样,在水溶液中讨论元素金属性或非金属性强弱就必须用到元素的电极电势这个概念。 所以说,上述提到的四个概念在是两种环境下(气态环境和在水溶液中)考察元素金属性与非金属性强弱的重要的定量标准。
重要概念
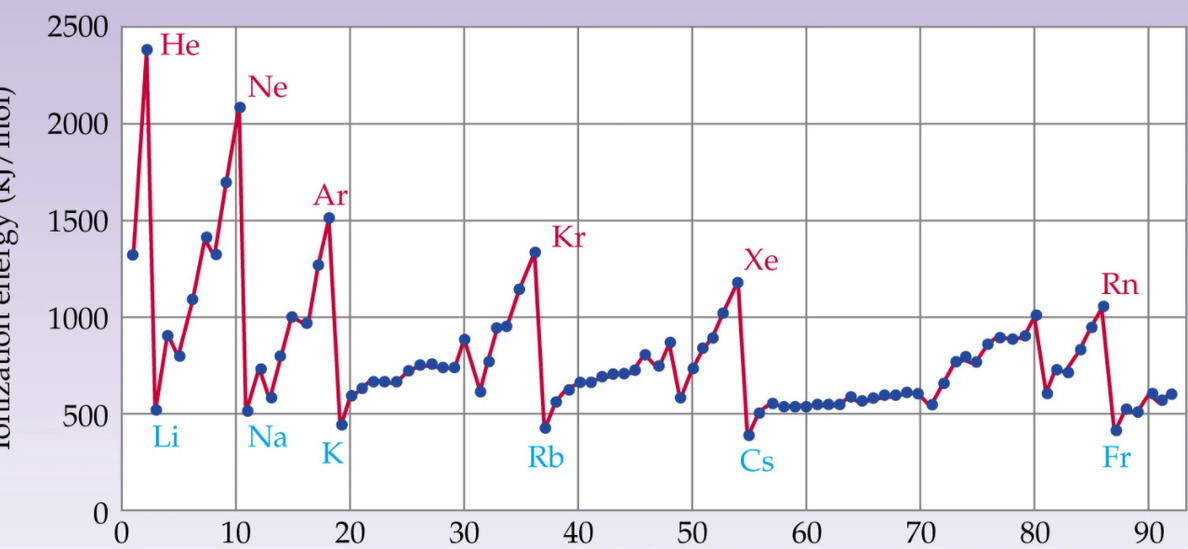
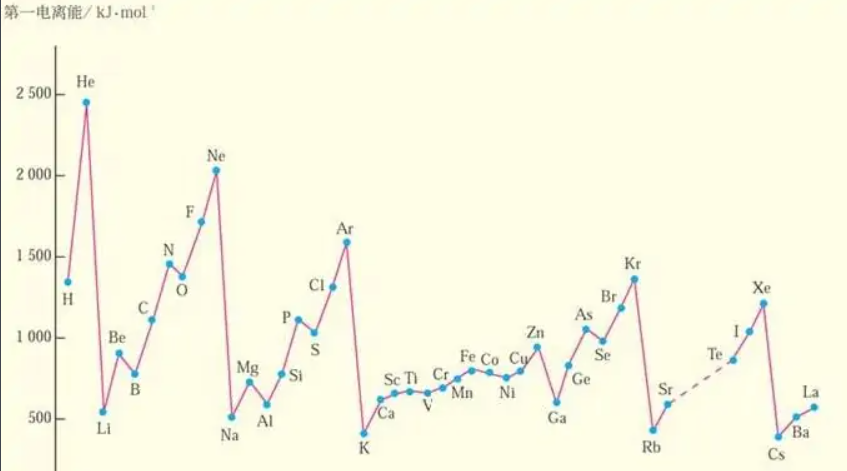
1 元素的电离能
对于多电子原子, 处于基态的气态原子生成H 气态阳离子所需要的能量,称为第一电离势,常用符号I1表示:
M (g)———M (g)+e第一电离势=I1(1可省去)。电离势应该为正值因为从原子取走电子需要消耗能量。元素的原子电离势越小,表示气态时越容易失去电子,即该元素在气态时的金属性越强。电离势的数值大小主要取决于原子的有效核电荷,原子半径以及原子的电子构型。一般来说, 同一周期的元素具有相同的电子层数,从左至右有效核电荷增大,原子的半径减小,核对外层电子的引力加大。因此,越靠右的元素, 越不易失去电子, 电离势也就越大,同一族元素电子层数不同,最外层电子数相同原子半径增大起主要作用。因此, 半径越大, 核对电子引力越小, 越易失去电子, 电离势也就越小。电子构型是影响电离势的第三个因素, 各周期中希有气体元素的电离势最大,部分原因是由于希有气体元素的电子具有相对稳定的8 电子最外层构型。某些元素具有全充满和半充满的电子构型,稳定性也较高。如Zn (3d 4S ),Cd(4d 5S ),Hg(5d 6 S)比同周期相邻元素的电离势高。 2 电子亲合势
当元素处于基态的气态原子获得一个电子成为负一价气态阴离子时所放出的能量, 称为该元素的第1 电子亲合势。电子亲合势越大, 该元素越容易获得电子。金属元素的电子亲合势都比较小, 说明金属在通常情况下难于获得电子形成负价阴离子。
早期的元素的电子亲合势数据不够完整。94 年李国胜撰文提出电子亲合势A =az′/(r)nl+b(r )nl+Co. 该式表示, A同时与两个常量z′/(r)nl及(r)nl相关, 而对同一元素, Z′/(r)nl与(r)nl间又有一定的制约关系。 其中, a, b, c表示常数, r为轨道半径,n、l 为轨道的主量子数和角量子数。又Z′/(r)nl代表价电子平均核势,(r)nl与核吸引能成反比, 在某种程度上则可反映电子间的排斥作用, 作为得电子能力标志的电子亲合能与这两种因素相关, 从物理概念上是不难理解的。 A的周期性变化实际上代表了Z′/(r)nl与(r)nl周期性变化, 同元素的原子半径, 电离能、电负性一样, 这种根本原因在于元素电子层结构的周期性变化。而Z′/(r)nl及(r)nl似乎更与这种微观电子结构联系起来。
3 元素的电负性
物质发生化学反应时, 是原子的外层电子在发生变化。原子对电子吸引能力不同, 是造成元素化学性质有差别的本质原因, 元素的电负性的概念, 就是用来表示元素相互化合时,原子在分子中吸引成键电子对的相对能力。因此鲍林定义电负性为“电负性是元素的原子在分子中吸引电子的能力”指定H的电负性为2 .1,求出了其它元素的相对电负性。
在周期表中每一周期元素从左到右电负性都是随着原子序数增加而逐渐变大;对于每一族的某些主族元素, 从下到上随着原子半径的减小而增大。这样一来,除了稀有气体,电负性最高的元素是周期表中右上方的氟(4.0), 电负性最低的元素是周期表中左下方的铯和钫(0.7), 一般来说,金属元素的电负性在2 .0以下,非金属元素的电负性在2 .0 以上。
4 元素的电极电势
对于金属元素而言,其电极电势是处于基态的原子与水溶液中的水合离子的电势差。它的大小取决于金属原子离子化的倾向及其它因素。由金属晶体到水合离子有三个过程:一、金属由固态转变为气态原子, 其升华热为S ;二、金属气态原子失去电子,变成气态离子, 电离能为IA;三、金属气态离子M气变为水合离子M水合,水合热为Q水合。 假想金属进入溶液中的状态直接为气态原子,不考虑其状态变化。这样,在水溶液中只存在金属气态原子和水合离子。已知金属晶体里有金属阳离子和公共化电子, 当把金属放到含有该金属离子的盐溶液时, 有两种反应倾向存在:一方面,金属表面的离子进入溶液和水分子结合成为水合离子;另一方面,溶液中的水合离子有从金属表面获得电子,沉淀到金属上的倾向。这里,也存在一个电子转移的过程和在以水为介质,金属原子与离子相互作用的过程。 因此,常用元素的电极电势高低来比较金属性或非金属性强弱。如上文提到的铜半电池的标准电极电势为+0.3419V,锌半电池的标准电极电势为-0.7618V。显然, 锌半电池的电极电势小于铜的, 因此说在溶液中锌比铜金属性强, 锌易失电子, 被氧化, 成为金属阳离子。在元素周期表中,电极电势虽然规律性不那么明显, 但也能反映元素金属性和非金属性的递变。 区别联系
四者虽然都是元素金属性和非金属性的量度, 但它们之间是有区别的。前三者是衡量原子得失电子能力大小的难易程度,即孤立原子电子结构稳定性大小的标志,而后者(电极电势)则是物质在水溶液中得失电子、形成水合离子趋势的量度。根据波恩—哈伯循环,有反应:M(aq)+e →M (s)。电离能只是电极反应过程中能量的一部分。一般说来电离能大,电子亲合能也大,但电极电势是否越正,还要看水合能大小。在周期表中, 随着原子结构的周期性变化,四者呈现周期化变化,电极电势虽然受影响因素较多,规律性不那么明显,但四者所判断的元素的金属性和非金属性变化规律基本一致。那么周期系中金属性和非金属性一般规律如何呢? 其中, 稀有气体元素的原子最外层电子是全充满的有最稳定的结构,因此无论失去或获得电子都很困难 ,电离能最大,电子亲合能为 0 , 电极电势难以测定。再看其它元素,同一周期从左至右 :四者的数值是逐渐增大, 金属性变弱 ;同一主族从上至下 ;四者的数值是逐渐变小, 金属性变强。而非金属性变化规律反之。