锆 锆(Zirconium)是第40号元素,元素符号为Zr,在 元素周期表 中位于d区,属第五周期IVB族,为过渡金属,核外电子排布式为[Kr]4d²5s²。 锆有两种结构,分别为六方晶系的α型和立方晶系的β型。 锆外观呈银灰色有光泽的金属或蓝灰色无定形粉末,不溶于水,微溶于酸,溶于 氢氟酸 和 王水 等,其原子量为91.224,密度为6.506 g/cm³。 锆具有很强的可塑性,且耐高温、耐腐蚀、耐辐射和耐酸。锆还可以储氢,且在高温下具有良好的吸气性。 锆可与水、酸和碱反应,释放出氢气; 可与氧、氢、氮和卤素等非金属单质发生加合反应,生成含锆二元化合物; 可在高温条件下吸收一氧化碳和二氧化碳,还可与四溴化锆等物质反应。 锆最主要的应用是制成合金,应用于原子能工业、电子工业、医疗 此外,锆金属可用于制造化工设备、钢铁冶金, 锆粉可用于生产烟花和武器。 锆还可作化工原料生产氧化锆等含锆化合物。 锆粉极易自燃,在受热、遇明火或接触氧化剂时会引起燃烧爆炸。 锆对眼睛、皮肤和黏膜具有刺激性,也可经呼吸道、消化道进入人体,过量时可造成锆中毒。
基本信息
发现者
马丁·亨瑞奇·克勒普鲁斯(Martin Heinrich Klaproth)
物理性质
蒸气压
1.05×10⁻¹⁰ Pa(1126.85 ℃), 6.17×10⁻⁸ Pa(1326.85 ℃)
原子性质
历史
发现 1789年,德国化学家马丁·亨瑞奇·克勒普鲁斯(Martin Heinrich Klaproth)在 斯里兰卡 开采的锆石中发现了一种未知元素的氧化物,即氧化锆,克勒普鲁斯便将这种新元素命名为“Zirconium”,取自阿拉伯语“Zargun”,意为金色。 1824年,瑞典化学家乔恩·贝采利乌斯(Jons Berzelius)通过加热 六氟锆酸钾 和 钾金属 而首次制备出了不纯的黑色粉末状锆。1914年,德国化学家莱利(D. Lely)和汗布格尔(Hamburger)用高纯钠还原四氯化锆并提纯制备出了高纯的韧性金属锆。1925年,荷兰化学家安东·爱德华·范阿克尔(Anton Eduard van Arkel)和贾恩·昂德里克·德布尔(Jan Hendrik de Boer)通过分解 碘化锆 制备出了极纯的锆。
工业发展 1944年,美国矿务局(U.S. Brreau of Mine)在克劳尔(W. J. Kroll)的指导下成功研发出了锆的大规模生产方法。 该法被称为Kroll法并沿用至今。 1947年,费舍尔(W. Fischer)等人首次研究出由溶剂萃取法分离锆和铪。1949年,美国橡树岭Y-12工厂首次在工业中成功分离锆和铪。1950年,美国原子能委员会(U.S.A.E.C.)决定在 核潜艇 上使用锆合金作为核反应堆的包套和结构材料,之后又逐渐应用于核发电站中。从20世纪70年代起,世界各国竞相发展核电,到80年代末,西方国家海绵锆年产能力达7000-8000 t。中国于1956年开始研制原子能级海绵锆,1964年第一个试验厂试车,1967年开始进行工业生产,到20世纪70年代初已建成较为完整的锆冶炼和加工的研究和生产体系。
分布情况 锆虽被称为稀有金属,但其在地壳中的含量却十分丰富,丰度为165 mg/kg。锆在岩石、土壤、海洋沉积物和海水中的平均浓度分别为170 ppm、300 ppm、132 ppm和4 ppb。 含锆的主要矿物有 锆石 ,成分为 ZrSiO₄ ,其分布最为广泛;铪锆石,成分为(Zr,Hf)SiO₄; 异性石 ,成分为(Na,Ca)₅ZrSi₆O₁₇(OH·Cl)₂; 斜锆石 ,成分为ZrO₂。锆矿床主要有锆石砂矿床,为冲积砂矿和 海滨砂矿 ,是由锆石与 独居石 、 钛石 、 钛铁矿 及 金红石 等组成综合性矿床,以及由岩浆形成的含斜锆石的碳酸岩矿床和含异性石的 碱性岩 矿床等。其中具有工业开采价值的矿物为锆石和斜锆石。 锆在自然界中常与铪共生,没有单独存在的形式。 世界探明锆石储量4900万吨,储量基础5800万吨,主要分布在澳大利亚、南非、美国、印度。 锆还广泛存在于生物体中。锆在植物中可存在于藻类、地衣、苔藓、蕨类和松柏类中。其在生物圈中具有迁移和富集效应,能紧密结合在有机物碎片、浮游生物表面和陆生苔藓植物中。锆还广泛分布在人和动物体内,其中以软组织分布最多。成年人体中锆的含量约为420 mg。 此外,大多数食品中也含有锆,新鲜肉中锆的平均含量约为1-3 mg/kg,水果和海产品则相对较少,人日均累积摄入锆含量约为3.5 mg。
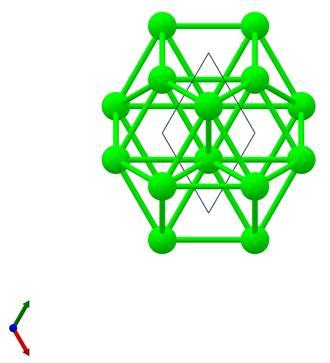
晶体结构 锆有两种结构,分别为α型和β型,在相变温度860-870 ℃以下时为α型,以上时为β型。 α型的锆晶体结构为六方晶系,属P63/mmc空间群。在α型锆晶体中,锆原子与十二个等效的锆原子成键,其中六根Zr-Zr键较短,键长为3.19 Å;另外六根Zr-Zr键较长,键长为3.24 Å。其晶胞参数为a=b=3.24 Å,c=5.17 Å;α=β=90°,γ=120°。晶体结构透视图如下:
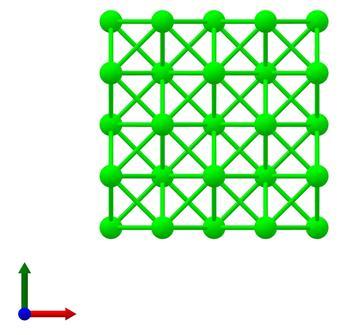
β型的锆晶体结构为立方晶系,属Fm3 m空间群。在β型锆晶体中,锆原子也与十二个等效的锆原子成键,Zr-Zr键长度均为3.20 Å。其晶胞参数为a=b=c=4.53 Å,α=β=γ=90°。晶体结构透视图如下:
理化性质
同位素 锆有5种天然稳定存在的同位素,为⁹⁰Zr、⁹¹Zr、⁹²Zr、⁹⁴Zr和⁹⁶Zr,其丰度分别51.45%、11.22%、17.15%、17.38%和2.80%。此外还有21种质量范围为80-89、93、95和97-105的人工放射性同位素。其中寿命最长的放射性同位素为⁹³Zr,半衰期为1.5×10⁶ 年;寿命最短的放射性同位素为¹⁰⁵Zr,半衰期为1 秒。
物理性质 锆外观呈银灰色有光泽的金属或蓝灰色无定形粉末,不溶于水。 锆具有很强的可塑性,且耐高温、耐腐蚀和耐酸。锆在有机酸中耐腐蚀,但在氢氟酸、 浓硫酸 、浓磷酸、王水、 溴水 、 氢溴酸 、 氟硅酸 、 次氯酸钙 、 氟硼酸 中不耐腐蚀。 锆的热中子俘获截面较小,为0.18 b,所以具有耐辐射性。 锆还可以储氢,且在高温下具有良好的吸气性, 能强烈地吸收氧气、氢气和 氮气 等气体。 锆的原子量为91.224,密度为6.506 g/cm³,熔点为1852 ℃,沸点为4377 ℃,电负性为1.33(鲍林标度), 第一电离能 为640.074 KJ/mol,比热容为278 J/(kg·K),蒸气压为1.05×10⁻¹⁰ Pa(1126.85 ℃),电阻率为38.8 microhm-cm(0 ℃),磁化率为1.55×10⁻⁶(cgs),杨氏模量为11.35×10⁶ psi(退火),剪切模量为5.42×10⁶ psi,泊松比为0.33。
化学性质 锆可与水、酸和碱反应,释放出氢气; 可与氧、氢、氮和卤素等非金属单质发生加合反应,生成含锆二元化合物; 可在高温条件下吸收一氧化碳和二氧化碳,还可与四溴化锆等物质反应。 锆在水溶液中以+4价形式存在,而在无水锆化合物中可以+1、+2、+3和+4价形式存在。 最常见的锆化合物为锆英石(ZrSiO₄)和氧化锆(ZrO₂),其余还包括 氢化锆 (ZrH₂)、 碳化锆 (ZrC)、 氮化锆 (ZrN)、 三氯化锆 (ZrCl₃)、 四氯化锆 (ZrCl₄)、 氯氧化锆 (ZrO Cl₂ ·8H₂O)、 氟化锆 (ZrF₄)、 锆氟酸钾 (K₂ZrF₄)、氟氧化锆(ZrOF₂)、 硫酸锆 [Zr(SO₄)₂]、碱色 碳酸锆 [Zr(OH)₂CO₃]、碱色硫酸锆[Zr(OH)₂SO₄]、磷酸锆(ZrO₂·nP₂O₅)、碳锆酸酰胺[(NH₄)₂ZrO(CO₃)₂]、碳锆酸酰钾[K₂ZrO(CO₃)₂]、偏高酸钙(CaZrO₃)和锆酸盐(BaZrO₃、MgZrO₃、PbZrO₃)等。
与水反应 锆是一种强烈的氢化物形成元素,易与水反应,随温度升高反应加速并释放出大量氢气,反应方程式如下:
与酸、碱反应 锆与 浓盐酸 在常温下不反应,加热至50 ℃开始缓慢反应,即使在100 ℃时也仍缓慢反应,生成 氯化锆 并放出氢气,反应方程式如下。锆与氢氟酸则可在常温下发生反应。 锆还可与 氢氧化钾 等碱类反应,生成锆酸钾并放出氢气,反应方程式如下:
与非金属单质反应
与氧气反应 锆可与氧气反应,生成氧化锆,反应方程式如下。粉末形式的锆易自燃形成氧化锆,根据粒度大小不同其着火点在80-285 ℃之间;固体金属锆则在常温下是稳定的,加热至200 ℃时可与氧气缓慢反应,在高温下迅速反应。 氧化锆生成后可在锆表面形成一层坚固的氧化膜,使得锆或锆合金具有优良的抗腐蚀能力。
与氢气反应 锆可在300-1000 ℃的温度下与氢气反应,生成性脆的 氢化锆 ,反应方程式如下。 在锆合金中此反应可引起氢脆效应,降低合金的延展性。
与卤素反应 锆可在200-400 ℃的温度下与卤素单质反应,生成四卤化锆,反应方程式如下:
与氮气反应 锆在400 ℃时可与氮气反应,800 ℃以上时反应迅速,生成难熔化合物 氮化锆 ,反应方程式如下。此外,锆在高温下还可与硫、磷和碳等非金属加合生成二元化合物。
与二氧化碳、一氧化碳反应 锆可在1000 ℃以上时与二氧化碳反应或在800 ℃以上时与一氧化碳反应,生成氧化锆和难熔化合物 碳化锆 ,反应方程式如下:
与四溴化锆反应 锆可与过量的四溴化锆在真空下于300 ℃反应,加热8小时后将四溴化锆转变为三溴化锆,反应方程式如下:
制备方法
矿物提取法 锆金属通常经由开采矿石提取而得,如锆石、斜锆石等。矿石经开采、粉碎后进行初步分离,分离出的矿石与碳混合并高温共热,生成碳化锆,将碳化锆在氯气中高温加热,转化为 四氯化锆 ,再经萃取将铪与锆分离。最后利用kroll法,即在 氦气 气氛中将四氯化锆蒸气用熔融镁还原即可得金属锆和 氯化镁 ,反应方程式如下。减压蒸馏除去氯化镁后即得金属锆成品。
锆粉的制备 锆粉可由氢化-脱氢法、还原法和电解法制得。由于锆粉是一种易燃易爆的危险品,所以制备后需进行钝化处理。
氢化-脱氢法 锆粉可以金属锆为原料,采用氢化﹣脱氢法制得。先将金属锆在高温下与氢气加合形成氢化锆,氢化锆经粉碎、分级得氢化锆粉末,将氢化锆粉末在高温下真空脱氢即制得锆粉。反应原理如下:
还原法 锆粉可由氧化锆还原制得。以纯净的氧化锆细粉为原料,用 金属钙 屑或氢化钙粉为还原剂,经高温还原反应即可制得锆粉。反应原理如下:
电解法 锆粉可由K₂ZrF₆电解制得。以纯净的K₂ZrF₆为原料进行电解,加入氯化钠以降低电解温度和提高电流效率, 电解产物 再经水洗、酸洗、水洗、真空烘干即可制得锆粉。反应原理如下:
检测方法
电感耦合等离子体质谱法
偶氮胂III光度法 锆含量可由偶氮胂III光度法进行检测。试样由氢氧化钠和水加热溶解后经硝酸酸化,由于硝酸中的 氧化氮 对偶氮胂III试剂有破坏作用,所以需加入少量 尿素 溶液将其分解。最后加入偶氮胂III溶液,偶氮胂III可与锆生成蓝色络合物,于665 nm处测定溶液吸光度,由标准曲线可得锆含量。
二甲酚橙光度法 锆含量可由二甲酚橙光度法进行检测。试样经盐酸溶解后,在加热条件下加入 过氧化氢 和水,煮沸冷却后再加入抗坏血酸溶液和二甲酚橙溶液, 二甲酚橙 溶液可与锆在酸性条件下生成红色络合物,于540 nm处测定溶液吸光度,由标准曲线可得锆含量。
其他方法 锆还可由火焰原子吸收法、电感耦合等离子发射光谱法和中子活化法等进行检测。
应用领域
锆的应用 纯锆金属具有优良的耐酸、碱性等,因此在化工、农药、化肥和染料等设备中用于反应器、泵、热交换器、阀门、搅拌器、喷嘴、热电偶套管、导管和容器衬里等的制造。锆丝可用作 空气等离子切割机 的电极头。锆屑可作炼钢添加剂,用于脱氧、脱氮;也可作 晶粒细化剂 ,用于铝合金的生产。锆粉可用于粉末冶金、生产焰火发光剂, 且锆粉摩擦时能发射出足以点燃 烃类 蒸气的高温火花
锆化合物的应用 应用最广泛的含锆化合物为氧化锆,可用作耐火材料、研磨材料、电子材料、玻璃添加剂、宝石原料、敏感器材料和精密陶瓷材料等。 此外,锆硅酸盐和锆氯氧化物可用于生产止汗剂和化妆品; 氰亚铁酸 锆和 柠檬酸 锆可用于清除人和动物体中的放射性锶;硫酸锆可用作蛋白质沉淀剂和皮革 鞣剂 ; 氟酸锆可作陶化剂以提高金属涂层的耐腐蚀性能。 锆化合物还可用于纯化受污染的水,清除其中的铅和砷等重金属元素。
锆合金的应用 锆可与其他金属或非金属制成合金,在原子能工业、电子工业、医疗器械制造及建筑材料制造等领域拥有广泛应用。
原子能工业 锆合金可用于原子能工业。由于锆具有熔点高、密度适中、强度高、可塑性强和中子俘获截面较小等优点,所以其合金可用作核反应堆、核燃料、核潜艇和铀棒的结构材料, 常用的锆合金有Zr-2、Zr-4、Zr-1Nb和Zr-2.5Nb等。 美国田纳西州橡树岭国家实验室中的核反应堆即由锆合金建造而成,用于进行铀的 裂变反应 。
电子工业 锆合金可用于电子工业。由于锆具有吸气性,可添加其他元素形成具有高吸收活性气体特性的合金用作 电子管 工业中的 吸气剂 。如锆石墨吸气剂可用于行波管、X光管和触发管等中,锆钒铁合金吸气剂可用于不锈钢真空保温杯、太阳能真空热水器和石油高效隔热管中。 由于锆合金具有相当好的电子放射性能,所以还可在电子工业中用于生产回转加速器及其他特种电子仪器等。
医疗器械制造 锆合金可用于医疗器械的制造。由于锆合金具有良好的力学性能、耐腐蚀性和生物相容性以及较低的弹性模量等优点,所以可用于医疗器械的制造, 如用于义肢、骨和肌肉的植入材料及可佩戴式人工肾脏的制造,还可用于血液过滤、血液透析和腹膜透析等检验中。
其他领域 由于锆合金具有高耐热性,所以可用于航天器零部件如火箭喷嘴、喷气发动机 在其他建筑领域中,锆合金还广泛应用于轴承、板材、管材、锻件、棒材、焊丝、磨料、陶瓷色料和耐火材料等的制造。
安全事宜
毒理学数据 LD₅₀ 大鼠口服:3.5-10 g/kg
职业接触极限 5 mg/cm³(TWA), 10 mg/cm³(STEL)
健康危害 锆对眼睛、皮肤和黏膜具有刺激性,也可经呼吸道、消化道进入人体,过量时可造成锆中毒。锆能抑制ATP酶、碱性磷酸酶和过氧化物酶等的活性,其沉积在骨骼中可能会导致维生素D抵抗的透析性软骨病的产生。锆还能引起急性和暴发性肺泡炎样超敏反应,症状表现为 干咳 和呼吸困难。锆具有抗原特性,可引起肺肉瘤样肉芽肿病等。
其他危害 锆粉极易自燃,在受热、遇明火或接触氧化剂时会引起燃烧爆炸,锆粉也能在二氧化碳及氮气中燃烧。
应对措施
急救 皮肤接触
脱去被污染的衣物,用流动清水冲洗并及时就医
眼睛接触
提起眼睑,用流动清水或生理盐水冲洗并及时就医
吸入
迅速脱离现场至空气新鲜处,保持呼吸道通畅并及时就医。若呼吸困难应进行输氧;若呼吸停止应立即进行人工呼吸
摄入
饮足量温水,催吐并及时就医
消防 若发生锆起火时,不得使用普通灭火器或水进行灭火,应使用干砂、粉状石墨或特殊金属粉末等进行灭火。
防护措施 呼吸系统防护
空气中粉尘浓度超标时,建议戴自吸过滤式防尘口罩
眼睛防护
空气中粉尘浓度超标时,建议戴化学安全防护眼镜
身体防护
穿一般作业防护服
手防护
戴防化学品手套
其他防护
操作场所应安装良好的通风设备;注意个人卫生习惯,严禁在工作场所吸烟、进食和饮水
储存与贮运 锆应严格按照放射性物质的运输规则进行运输,且货物包装上要有明显的放射性标志,运输中使用过的车皮等要进行用后清洗,装卸作业要穿戴防护用品,同时要防止撒漏和粉尘飞扬。锆应储存在非易燃容器和封闭区域中,不得与食品、易燃易爆物品等混放。 锆粉须在干燥氩气中存放,可用玻璃瓶或金属桶盛装并外加箱皮保护,不得与氧化剂混放。