溴 溴单质球棍模型
溴(英语 元素周期表 的第四周期VIIA族 卤族元素 ,化学符号为Br, 原子序数 为35,原子量为79.904。 溴是常温常压下唯一的液态非金属元素,并且溴有固、液、气三种形态,固态溴是带金属光泽的黄绿色晶体,微溶于水,易溶于苯、乙醇等有机溶剂,溶于盐酸、 溴化钾 、 氢溴酸溶液 ;液态溴为暗红棕色,常温下易挥发且具有独特的窒息臭味、强刺激性、腐蚀性;气态溴为红棕色。溴作为一种卤素,具有强氧化性,溴能与金属、非金属单、氧化物、酸、碱、盐等发生反应。 溴及其化合物的应用领域广泛,能够用作 阻燃剂 、医药中间体和消菌剂等。
基本信息
物理性质
比热容
液体:77.735~75.634 J/(mol·K)(-7.25~26.85 °C)
固体:7.217~61.638 J/(mol·K)(-258.15~-7.25 °C)
气体:36.049~40.007 J/(mol·K)(24.85~5726.85 °C)
原子性质
危险性
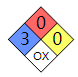
NFPA 7 04
溴单质
健康危害等级:3(在紧急情况下,有可能造成严重或永久性损伤)
可燃性等级:0(不会燃烧)
稳定性等级:0(通常情况下稳定,即使在火灾条件下也是如此) 特殊危害性:OX(氧化剂)
发现历史 1824年, 法国蒙彼利埃大学 (Université de Montpellier)的助理巴拉尔(A.J.Balard)在研究 地中海 的各种藻类是否含有碘时,发现向氯水和淀粉的混合溶液中加入海产植物岩藻(Fucus)的灰烬后,溶液会分层且下层呈现蓝色,上层出现橙黄色。 而后巴拉尔在研究 蒙彼利埃 (Montpellier)盐湖中的一种海藻植物时,发现在 母液 中通入 氯气 后溶液会变红,加入氯水和淀粉,溶液也会分为上下两层。巴拉尔有了两种设想:氯与母液中的碘生成了化合物、氯从母液中置换出了一种新元素。为了确定棕黄色物质组成,巴拉尔进行了一系列实验得到了一种深红棕色的液体,巴拉尔推断这是一种在室温下呈液态的非金属元素,在导师安格拉达Joseph Anglada的建议下,巴拉尔根据其起源将这种新元素命名为muride(盐质),来自拉丁文muria( 盐水 )。 1826年8月14日, 法国巴黎科学院 指定的特别审查委员会承认了巴拉尔的新发现,并将这种新元素重新命名为Bromine(溴),来自希腊文brōmos,意为“恶臭”。
在巴拉尔A.J.Balard发现溴以前,德国化学家乔斯J.R.Joss和 李比希 Justus von Liebig 二人都曾得到过溴,只是他们都误认为这不是一个新元素,乔斯以为是硒,李比希则以为是 氯化碘 ,而巴拉尔则认为这是一个与氯和碘有相似之处的新元素。 溴元素的发现具有重大的历史意义,不仅促进了卤族雏形的形成,也为元素周期律的发现提供了依据:溴作为第3个被发现的卤族元素,它与 氯元素 和碘元素性质的相似性为德国化学家 德贝莱纳 Jo- hann Wolfgang Döbereiner提出的“三元素组”假说提供了依据,在此之前,元素被认为是独立的实体,元素之间没有联系,直到1829年,德贝莱纳在散乱无章的元素中找到其性质逐步变化的规律,因此溴的发现表明元素可以归入具有类似性质的族中。
分布情况 溴含量稀少但是分布广泛,在地壳中的丰度为 。溴资源是非独立集中 盐卤 4种,其中海水中溴含量占地球上溴总资源量的99%,海水中溴的浓度约为65 mg/L,因此溴素也被称为“海洋元素”。 全球最具代表性的溴资源分布区域有以下几个: 死海 ,溴含量10000-12000 mg/L;美国阿肯色州地下卤水,溴含量5000-6000 mg/L;印度盐湖,溴含量2600-3200 mg/L; 乌克兰 浅海,溴含量600-1000 mg/L;中国莱州湾地下卤水,溴含量200-300 mg/L;中国 海水制盐 副产 苦卤 ,溴含量400-500 mg/L。其中以死海为代表的内陆 盐湖 和 美国阿肯色州 的地下卤水溴资源品质最优、产量最高。
物质结构 溴原子的电子组态为【Ar】3d¹⁰4s²4p⁵,与其他卤素原子一样, 最外层电子数 都是7个,在化学反应中容易获得1个电子形成最外层8个电子的稳定结构。从F到I 原子核 电荷、 电子层数 、原子半径逐渐增大,故 非金属性 逐渐减弱 溴和其他卤素单质均为双原子 非极性分子 ,分子间以 色散力 结合。随卤素相对分子质量的增大,F₂、Cl₂、Br₂、I₂的物态分别为气体、气体、液体、固体。卤素单质结合电子的能力,即氧化性的对比为F₂>Cl₂>Br₂>I₂.
理化性质
物理性质 溴是常温常压下唯一的液态非金属元素,固态溴是带金属光泽的黄绿色晶体,微溶于水,易溶于 苯 、 乙醇 等有机溶剂,溶于 盐酸 、溴化钾、氢溴酸溶液;液态溴为暗红棕色,常温下易挥发且具有独特的窒息臭味、强刺激性、腐蚀性;气态溴为红棕色。
化学性质 溴作为一种卤素,具有强氧化性(卤素氧化性比较:F₂>Cl₂>Br₂>I₂)。 一般能和氯反应的金属、非金属也能与溴反应, 溴还能与酸、碱、盐、 氧化物 等发生反应。
与单质反应
非金属 溴能在加热的条件下与 氢气 反应生成溴化氢。
溴能与其他卤素(氟、氯、碘)发生反应,如溴与氟直接反应可以生成BrF,将 氟气 通过100 ℃的 液溴 可以生成BrF₃,在200 ℃下溴能与氟反应生成BrF₅。 溴与氧气反应,低温低压 辉光放电 条件下生成BrO₂,无声放电影响下生成BrO₃。 溴能与硫在 水浴 加热的条件下反应。
金属 溴能与 锂 、钠、钾、钙、 铝 、银、金等金属反应生成 溴化物 。
与酸反应 溴与酸反应,大多数情况生成氢溴酸,少部分生成溴化物、溴酸或 高溴酸 。
与碱性物质反应
与盐反应 溴与非氧化性盐反应,能生成溴化物或氢溴酸。
溴与氧化性盐反应能生成溴酸盐或溴酸。
与氧化物反应 溴与氧化物反应能生成溴化物或氢溴酸,少部分可以生成 次溴酸 或溴酸。
与有机物反应
溴的化合物
溴的氧化物
一氧化二溴 一氧化二溴为棕黑色固体,该化合物不稳定,在-40 °C以上会分解为溴和氧。
一氧化二溴可由溴蒸气与 氧化汞 作用,或者由冷的溴的四氯化碳溶液与氧化汞作用而得:
二氧化溴 二氧化溴为一种亮黄色晶体,它可以在低温下、有机溶剂中由溴和 臭氧 作用制得: 固体二氧化溴具有多聚结构,温度高于-40 °C时很不稳定,当温度升高至0 °C时立即强烈地分解为溴和氧。
除此以外,溴的氧化物还有三氧化溴、八氧化三溴等。
次溴酸及其盐 在次溴酸中,溴呈现最低的正氧化态,即+1价态,可通过溴单质在水溶液中歧化得到;溴酸很不稳定,只存在于水溶液中。
次溴酸盐可以作为氧化剂,但其氧化能力没有 次氯酸盐 强。
溴化银
同位素 溴共有45个 同位素 ,其中有两种天然存在的稳定同位素⁷⁹Br和⁸¹Br,除此之外,还有小部分不稳定同位素,它们是由于宇宙线引起的核变化及裂变而产生的;在溴已知的17个放射性同位素中,⁷⁷Br的寿命最长,半衰期为57个小时。
制备方法
溴的实验室制法 在实验室中,在酸性条件下,利用氧化剂将溴化物氧化来制备单质溴,例如:
在前一反应中, 二氧化锰 是氧化剂, 稀硫酸 提供酸性介质;对于后一反应, 浓硫酸 既能提供酸性环境,又可起到氧化剂的作用。
溴的工业提取 溴素的生产方法有 水蒸气蒸馏法 、 空气吹出法 、溶剂萃取法、吸附法和沉淀法等,其中工业上主要采用的方法为空气吹出法和水蒸气蒸馏法。
空气吹出法 空气吹出法以海水制盐场的中级卤水或地下卤水为原料,其做法是将氯气及硫酸通入卤水中,将离子溴氧化成游离溴,而后使用压缩空气将卤水中的游离溴吹出,接着用纯碱液或 二氧化硫 喷雾、捕沫、顺流吸收得到完成液,完成液晶蒸馏塔蒸馏、冷却、精馏,即可得到成品溴。
水蒸气蒸馏法 水蒸气蒸馏法以苦卤或浓厚卤(生产 氯化钾 的母液)为原料,通过 蒸馏塔 、冷凝器、溴水分离瓶等设备,先使用氯气将卤水中的溴离子氧化成游离溴,而后再增大水蒸气压力,利用溴在水溶液上方的蒸汽压随温度上升而增大的特性,将溴蒸汽从卤水中分离,经冷凝、分离、精馏、冷却等方式处理得到成品溴。
应用领域 溴是重要的化工原料之一,被广泛应用于阻燃剂、医药、军工、农药等领域。
阻燃剂 溴是元素中灭火能力最强的元素,其最大的应用领域就是生产 含溴阻燃剂 , 溴系阻燃剂 的产量占有机阻燃剂的40%。 溴系阻燃剂主要通过溴素与有关有机物反应制得,其经典产品生产工艺成熟、性价比高、应用广泛。溴系阻燃剂的分解温度与高分子合成材料相匹配,少量使用就能达到很好的阻燃效果,适合应用于火灾易发的电子电气产品中。
医药中间体 医药应用是溴产品的重要应用领域之一,溴可用于制备医药中间体。以下是几种已投入使用且前景较好的溴系医药中间体主: 溴代环丙烷 (C₃H₅Br),可用于制备 环丙沙星 、恩罗沙星等多种氟喹诺酮类抗菌药物;氟溴甲烷(CH₂BrF),可用于合成含氟医药、含氟农药等; 对溴甲苯 (C₇H₇Br),可用于生产对溴溴苄、对溴二溴苄、对溴苯甲醛等中间体等。
杀菌剂 溴能够氧化分解化合物,具有强效杀虫杀菌能力,农业上许多高效低毒农药生产都需要用到溴。含溴农药主要有杀菌剂、 除草剂 以及杀虫杀螨剂这几类。含溴杀菌剂大多具有强效、易分解、低毒、无残留等优点;除草剂 溴苯腈 具有高效除草性能和对作物的安全性; 溴螨酯 防治谱广,是杀螨剂中销售额最大的品种之一。
橡胶 溴可用于生产 溴化丁基橡胶 ,该橡胶除了具有 丁基橡胶 的耐热、耐酸碱、耐臭氧、低气体和湿气渗透性、耐老化等优异性能,还有易与其他橡胶并用形成共交联结构等特性。溴化丁基橡胶硫化速度快、硫化效率高、 硫化机 用量少、可实现无硫无锌化,具有非常广阔的工业应用价值和前景。
安全事宜
消防相关 溴本身不可燃,但与钾、磷、锡以及多种化合物结合时,可能会导致有机材料自燃;与乙炔、氨、 丙烯腈 、 羰基镍 等能发生爆炸性反应。溴在火中会释放出刺激性或有毒烟雾。 处理与溴有关的火灾时,消防人员需要佩戴正压式呼吸器、穿好防护服,可以使用水、干粉、二氧化碳等进行灭火。
环境污染 溴代阻燃剂多来源于电子废弃物和非点源排放,这类阻燃剂对沉积物与水、土壤、大气都有较高的污染水平,长期暴露于有毒溴化物往往会对生物产生有害影响。
其中 多溴联苯醚 已成为普遍存在的污染物,其中有研究显示 六溴环十二烷 近年来在环境中的浓度略有上升,六溴环十二烷具有环境持久性和生物毒性,可以长距离迁移及生物富集,已被列入《斯德哥尔摩公约持久性有机污染物框架》和《保护东北大西洋的海洋环境公约》的优先控制化学物质名单。
健康安全 溴有刺激性气味,对皮肤、眼睛和呼吸系统有刺激作用,人在浓缩溴氨中短暂停留就会出现呼吸系统炎症和充血及肺水肿的症状,有时甚至死亡;液溴还能使皮肤及其他器官组织产生刺激或坏死,灼伤不仅疼痛且难愈合。由于溴具有较大的挥发性,比碘更危险,因此溴在操作过程要采取严格的安全措施:避免溴与皮肤、眼睛及衣物接触,在操作时应使用防护眼镜、手套和 防护面罩 ;并且操作时应当保持良好通风防止吸入蒸气。若不慎吸入或接触到 溴水 ,应当迅速脱掉沾到溴的衣物,先以大量清水彻底冲洗伤面,再使用中和剂进行处理。 表1是溴的急性暴露指导水平(AEGL)。
AEGL
10分钟
30分钟
60分钟
4小时
8小时
AEGL 1/ppm
0.033
0.033
0.033
0.033
0.033
AEGL 2/ppm
0.55
0.33
0.24
0.13
0.095
AEGL 3/ppm
19
12
8.5
4.5
3.3
表1:溴的急性暴露指导水平
注:AEGL1代表明显的不适、刺激或某些无症状的非感觉效应。但是,这些影响不会致残,并且在停止接触后是短暂的和可逆的;AEGL2代表不可逆或其他严重、持久的不良健康影响或逃生能力受损;AEGL3威胁生命的影响或死亡。
急救措施 溴急性中毒时,要将患者迅速从现场转移,做好保温和给氧,保持呼吸通畅,视情况使用支气管解挛剂、镇咳剂;眼部灼伤者,使用2% 碳酸氢钠 溶液冲洗眼睛;皮肤灼伤者,立即使用大量清水冲洗,接着用5%碳酸氢钠溶液湿敷。严格控制感染症状后及时就医。