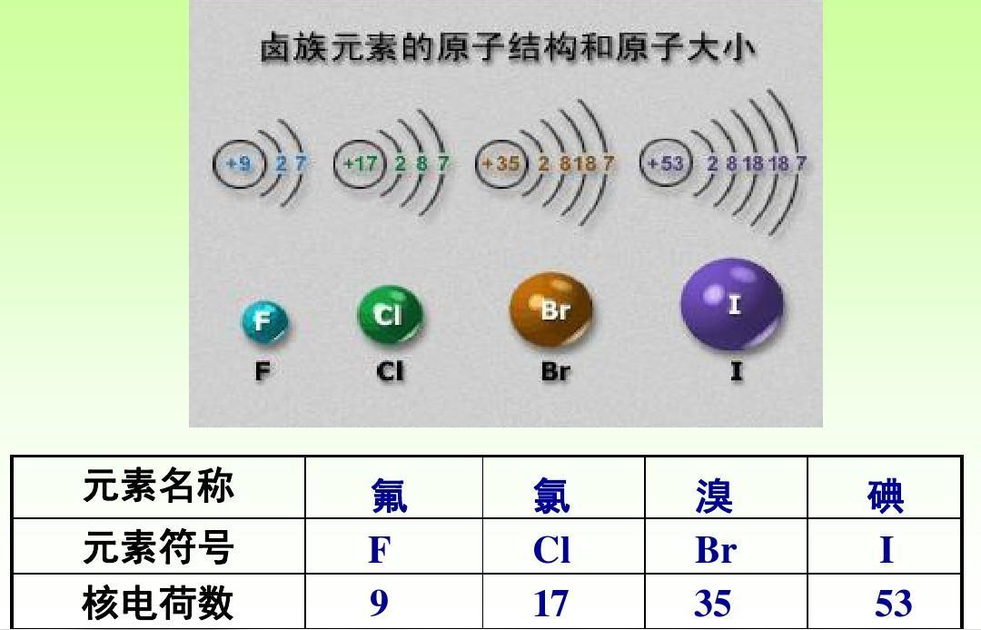
原子结构特征
最外层电子数相同,均为7个电子,由于电子层数不同,原子半径不同,从F~I原子半径依次增大,因此原子核对最外层的电子的吸引能力依次减弱,从外界获得电子的能力依次减弱,单质的氧化性减弱。 相似性
卤素的化学性质都很相似,它们的最外电子层上都有7个电子,有取得一个电子形成稳定的八隅体结构的卤离子的倾向,因此卤素都有氧化性,原子半径越小,氧化性越强,因此氟是单质中氧化性最强者。除F外,卤素的氧化态为+1、+3、+5、+7,与典型的金属形成离子化合物,其他卤化物则为共价化合物。卤素与氢结合成卤化氢,溶于水生成氢卤酸。 2F2(g)+2H2O(l)=4HF(aq)+O2(g)
X2(g)+H2O(l)⇌HX(aq)+HXO(aq) X=表示Cl Br I 卤素之间形成的化合物称为互卤化物,如ClF₃(三氟化氯)、ICl(氯碘化合物)。卤素还能形成多种价态的含氧酸,如HClO、HClO₂、HClO₃、HClO₄。卤素单质都很稳定,除了I₂以外,卤素分子在高温时都很难分解。卤素及其化合物的用途非常广泛。例如,我们每天都要食用的食盐,主要就是由氯元素与钠元素组成的氯化物,并且还含有有少量的MgCl₂。 递变性
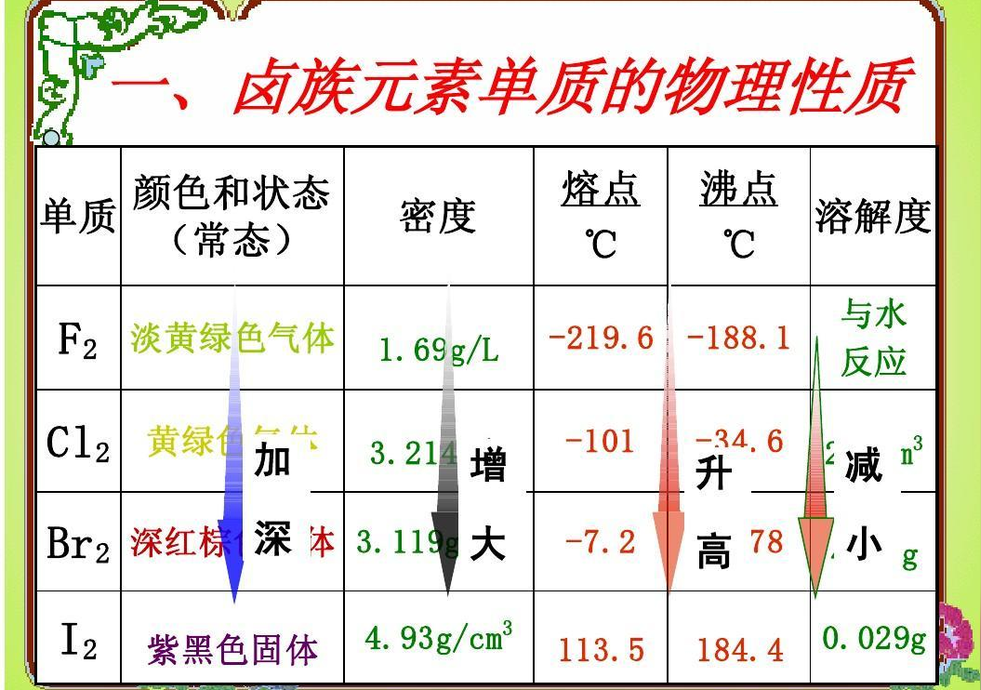
单质的物理递变性:从F2到I2,颜色由浅变深;状态由气态、液态到固态;熔沸点逐渐升高;密度逐渐增大;溶解性逐渐减小。 单质氧化性:F2>Cl2>Br2>I2
阴离子还原性:F
卤素单质的毒性,从F开始依次降低。
另外,卤素的化学性质都较活泼,因此卤素只以化合态存在于自然界中。
氢化物沸点有所不同:HF>HI>HBr>HCl,原因是HF有氢键沸点最高,其他随分子量变大分子间作用力增大,沸点升高 | 条件 | 特殊现象 | 产物稳定性 | |
F2 | 暗处 | 剧烈化合并发生爆炸 | 很稳定 | H2(g)+F2(g)= 2HF(g) |
Cl2 | 光照或点燃 | ——————— | 较稳定 | H2(g)+Cl2(g)=2HCl(g)(点燃或光照) |
Br2 | 加热 | ——————— | 稳定性差 | H2(g)+Br2(g)= 2HBr(g)(加热) |
I2 | 不断加热 | 缓慢反应 | 不稳定 | H2(g)+I2(g)=2HI(g)(不断加热) |
结论:随着核电荷数的增加,卤素单质与H2反应变化:F2、Cl2、Br2、I2 ①剧烈程度:逐渐减弱 ②生成HX的稳定性:与氢反应的条件不同,生成的气体氢化物的稳定性不同, HF>HCl>HBr>HI。
无氧酸的酸性不同:HI>HBr>HCl>HF。
氯气难溶于饱和氯化钠溶液,而碘易溶于碘化钾溶液(生成I3)
注意:萃取和分液的概念
·在溴水中加入四氯化碳振荡静置有何现象?(分层,下层橙红色上层无色)
·在碘水中加入煤油振荡静置有何现象?(分层,上层紫红色,下层无色) 卤离子的鉴别
氯离子:得白色沉淀 Ag(aq)+ Cl(aq)——→AgCl(s) 溴离子:得淡黄色沉淀 Ag(aq)+ Br(aq)——→AgBr(s)
碘离子:得黄色沉淀 Ag(aq)+ I(aq)——→AgI(s)
卤素的物理、化学特性
通常来说,液体卤素分子的沸点均要高于它们所对应的烃链(alcane)。这主要是由于卤素分子比烃链更易电极化,而分子的电极化增加了分子之间的连接力(正电极与负电极的相互吸引),这使我们需要对液体提供更多的能量才能使其蒸发。 卤素的物理特性和化学特性明显区分与于它对应的烃链的主要原因,在于卤素原子(如F、Cl、Br、I)与碳原子的连接,即C-X的连接,明显不同于烃链C-H连接。 * 由于卤素原子通常具有较大的负电性,所以C-X连接比C-H连接更加电极化,但仍然是共价键。 * 由于卤素原子相较于碳原子,通常体积和质量较大,所以C-X连接的偶极子矩(Dipole Moment)和键能(Bonding Energy)远大于C-H,这些导致了C-X的连接力(Bonding strength)远小于C-H连接。
* 卤素原子脆弱的p轨道(Orbital)与碳原子稳定的sp轨道相连接,这也大大降低了C-X连接的稳定性。
位于元素周期表右方的卤族元素是典型的非金属。卤素的电子构型均为nsnp,它们获取一个电子以达到稳定结构的趋势极强烈。所以化学性质很活泼,自然状态下不能以单质存在,一般化合价为-1价,即卤离子(X-)的形式。
卤素单质都有氧化性,氧化性从氟到碘依次降低。碘单质氧化性比较弱,三价铁离子可以把碘离子氧化为碘。
卤素单质在碱中容易歧化,方程式为:
3X(g)+6OH(aq)——→5X(aq)+ XO3(aq)+3H2O(l)
但在酸性条件下,其逆反应(归中)很容易进行:
5X(aq)+XO3(aq)+6H(aq)——→3X2(g)+3H2O(l)
这一反应是制取溴和碘单质流程中的最后一步。
卤素的氢化物叫卤化氢,为共价化合物;而其溶液叫氢卤酸,因为它们在水中都以离子形式存在,且都是酸。氢氟酸一般看成是弱酸,pKa=3.20。氢氯酸(即盐酸)、氢溴酸、氢碘酸都是化学中典型的强酸,它们的pKa均为负数,酸性从HCl到HI依次增强。 卤素可以显示多种价态,正价态一般都体现在它们的含氧酸根中:
卤素的含氧酸均有氧化性,同一种元素中,次卤酸的氧化性最强。
卤素的含氧酸多数只存在于溶液中,而少数盐是以固态存在的,如碘酸盐和高碘酸盐。HXO(X=F、Cl、Br)、HIO3和HXO4(X=Cl、Br、I)分子在气相中十分稳定,可用质谱和其他方法研究。卤素存在的含氧酸见下表。 HXO | HFO | HClO | HBrO | HIO |
HXO2 | | HClO2 | | HIO2 |
HXO3 | | HClO3 | | HIO3 |
HXO4 | | HClO4 | HBrO4 | |
其他 | | | | H7I5O14 |
展开表格
卤素的氧化物都是酸酐。像二氧化氯(ClO2)这样的偶氧化态氧化物是混酐。 只由两种不同的卤素形成的化合物叫做互卤化物,其中显电正性的一种元素呈现正氧化态,氧化态为奇数。这是由于卤素的价电子数是奇数,周围以奇数个其它卤原子与之成键比较稳定(如IF7)。互卤化物都能水解。 卤素的有机化学反应
在有机化学中,卤族元素经常作为决定有机化合物化学性质的官能团存在。
氯的存在范围最广,按照氟、溴、碘的顺序减少,砹是人工合成的元素。卤素单质都是双原子分子,都有很强的挥发性,熔点和沸点随原子序数的增大而增加。常温下,氟、氯是气体、溴是液体,碘是固体。
卤素最常见的有机化学反应为亲核取代反应(nucleophilic substitution)。 通常的化学式如:
Nu + R-X =R-Nu + X
"Nu-"在这里代表亲核负离子,离子的亲核性越强,则产率和化学反应的速度越可观。
"X"在这里代表卤素原子,如F、Cl、Br、I,若X所对应的酸(即HX)为强酸,那么产率和反应的速度将非常可观,如果若X-所对应的酸为弱酸,则产率和反应的速度均会下降。 卤素的制成:
* 从一个未饱和烃链制作卤素为最简单的方式,通过加成反应,如: CH3-CH2-CH=CH2+ HBr——→CH3-CH2-CH(Br)-CH? 不需要催化剂的情况下,产率90%以上。
* 如果希望将Br加在烃链第一个碳原子上,可以使用Karasch的方式: CH3-CH2-CH=CH?+ HBr ——→ CH3-CH2-CH2-CH2-Br + H2O
催化剂:H2O?
产率90%以上。
* 从苯制作卤素则必须要通过催化剂,如:
催化剂:FeBr3或者AlCl3
产率相当可观。
* 从酒精制作卤素,必须通过好的亲核体,强酸作为催化剂以提高产率和速度: CH3-CH2-CH2-CH2-OH + HBr ——→CH3-CH2-CH2-CH2-Br + H2O 注意此反应为平衡反应,故产率和速度有限。
ⅦA 族元素包括氟( F )、氯 (Cl) 、溴( Br )、碘( I )、砹( At ),合称卤素。其中砹( At )为放射性元素,在产品中几乎不存在,前四种元素在产品中特别是在聚合物材料中以有机化合物形式存在。应用于产品中的卤素化合物主要为阻燃剂: PBB , PBDE , TBBP-A , PCB ,六溴十二烷,三溴苯酚,短链氯化石蜡;用于做冷冻剂、隔热材料的臭氧破坏物质: CFCs 、 HCFCs 、 HFCs 等。 危害:在塑料等聚合物产品中添加卤素(氟,氯,溴,碘)用以提高燃点,其优点是:燃点比普通聚合物材料高,燃点大约在 300℃ 。燃烧时,会散发出卤化气体(氟,氯,溴,碘),迅速吸收氧气,从而使火熄灭。但其缺点是释放出的氯气浓度高时,引起的能见度下降会导致无法识别逃生路径,同时氯气具有很强的毒性,影响人的呼吸系统,此外,含卤聚合物燃烧释放出的卤素气在与水蒸汽结合时,会生成腐蚀性有害气体(卤化氢),对一些设备及建筑物造成腐蚀。
PBB , PBDE , TBBPA 等溴化阻燃剂是使用较多的阻燃剂,主要应用在电子电器行业,包括:电路板、电脑、燃料电池、电视机和打印机等等。 这些含卤阻燃剂材料在燃烧时产生二恶英,且在环境中能存在多年,甚至终身累积于生物体,无法排出。 因此,不少国际大公司在积极推动完全废止含卤素材料,如禁止在产品中使用卤素阻燃剂等。
然而对于无卤化的要求,不同的产品有不同的限量标准:
如无卤化电线电缆其中卤素指标为:所有卤素的值 ≦50PPM
(根据法规 PREN 14582) :燃烧后产生卤化氢气体的含量<100PPM
(根据法规 EN 5067-2-1) :燃烧后产生的卤化氢气体溶于水后的 PH 值大于等于4.3( 弱酸性 )
(根据法规 EN-5 0267-2-2):产品在密闭容器中燃烧后透过一束光线其透光率 ≧60%
(根据法规 EN-50268-2) 。
元素名称 | 氟 | 氯 | 溴 | 碘 |
状态 | 气体 | 气体 | 液体 | 固体 |
颜色 | 淡黄色 | 黄绿色 | 棕红色 | 紫黑色 |
单质还原性 | 逐渐减小 |
氢化物的酸性 | 逐渐增强 |
活性 | 逐渐减弱 |
国际法规
IEC 61249-2-21
印刷电路版材料和其他互联结构-2-21部分:包被和非包被增强基材,阻燃剂(垂直燃烧试验)铜包被的无卤素环氧编织E型玻璃纤维增强层压板(规定电路板的所有材料的卤素)。 ·氯限值≤900ppm
·溴限值≤900ppm
·溴+氯含量≤1500ppm
国际印刷电路协会标准 IPC4101B
·氯限值≤900ppm
·溴限值≤900ppm
·溴+氯含量≤1500ppm
日本印刷电路板协会(JPCA-ES-01-1999)
·氯限值≤900ppm
·溴限值≤900pp
卤素单质在不同溶剂中的颜色
| 氯 | 溴 | 碘 |
水 | 黄绿色 | 黄色至橙色 | 深黄色至褐色 |
苯 | 橙色至橙红 | 浅紫色至紫色 |
四氯化碳 | 紫色至深紫色 |
汽油 | 浅紫红色至紫红 |
酒精 | 棕色至深棕色 |
·