氦 氦(英文名称:Helium),稀有气体元素,位于 元素周期表 的第一周期零族,元素符号为He,原子序数为2, 摩尔质量 为4.00260g/mol,是一种无色无味的气体。 氦元素在 地球 的含量并不多,但是在 宇宙 是第二丰度的元素,仅次于 氢 元素。 氦属于最轻的惰性元素,在自然界中有最稳定的 He和 He两种 同位素 ,还有寿命很短的人造放射性同位素 He~ He。氦气常压下的沸点为-268.93℃,熔点为-272.2℃,是最难液化的气体。 氦气在低温超导、医学成像、 半导体 、设备检漏以及焊接等领域被广泛使用。
基本信息
物理性质
临界点
临界温度-267.9℃,临界压力约0.225MPa
原子性质
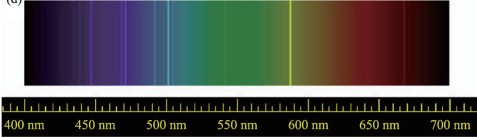
相关历史 1868年8月18日, 法国 天文学家 皮埃尔·让森 (Pierre-Jules-César Janssen)在 印度 观察 日全食 时,发现在太阳光谱中观察到一条黄线D3(587.49nm)和钠光谱的D1(589.6nm)和D2(589.0nm)两条线不相同。1868年10月20日, 英国 天文学家 约瑟夫·诺曼·洛克耶 (Norman Lockyer)也观测到这条黄线D3。 洛克耶 和英国 爱德华·弗兰克兰 (E. F. Frankland)认为这条线只有太阳才有,并且还认为是一种金属元素。所以把这个元素取名为Helium(元素符号为He,helio希腊文是 太阳神 的意思,后缀-ium是指金属元素而言。中译名为氦)。 1881年,意大利物理学家路易吉·帕尔米耶里(Luigi Palmieri)在分析 维苏威火山 的岩浆时发现了氦的D3线,这是氦在地球上的首次发现记录。 1895年, 苏格兰 化学家 威廉·拉姆塞 (William Ramsay)将含 氧化铀 (UO 2 )的矿 石放入 硫酸 中时,产生了一种神秘的气体。 但是由于他没有更精密的仪器测定谱线在光谱中的位置,于是将这种气体样品送给了英国 伦敦 物理学家 威廉·克鲁克斯 (William Crookes)做进一步的鉴定,威廉·克鲁克斯通过更精确的光谱实验后,证实了这种气体就是氦,并证实了氦元素也是一种稀有气体。这也是首次在地球上分离出氦。 十九世纪、二十世纪之交,低温研究在整个科坛中影响很大。1908年7月13日晚,荷兰物理学家卡美林·奥涅斯(Heike Kamerlingh Onnes)和他的助手们第一次得到了320cm 的液态氦,并且达到了 苏联 科学家卡比查发明了新型的液氦机。 上世纪70年代初,美国康奈尔大学教授戴维·李和 罗伯特·理查森 , 斯坦福大学 教授 道格拉斯·奥谢罗夫 发现在0.002K的温度时 He能变成超流体,这与30年代发现的氦的另一同位素 He有很大区别。这三人于1996年被授予了诺贝尔物理学奖,以表彰他们发现了的同位素 He的超流体现象。
分布情况 氦元素在地球的含量并不多,但在宇宙是第二丰度的元素,仅次于氢。氦在整个宇宙按质量计算占23%。氦在地球的主要来源并不是空气,而是来自于天然气。氦在天然气中的含量是在空气中含量的1.5万倍,但是这种高氦的天然气矿藏并不多,因为天然气中的氦气是铀之类的放射性元素衰变的产物,一般认为天然气中氦含量达到0.1%即可以被工业利用,一般只有在天然气矿附近有铀矿时,氦气才能在天然气中汇集。
同位素 氦共有8种同位素的同位素, He~ He为寿命很短的人造放射性同位素,在自然界中最稳定的是 He和 He。 He在地球上集中 He在宇宙中是宇宙射线轰击大气圈中的氮产 H,由 H转化来的 He称为宇宙成因氦。 He是由U和Th等元素放射性元素衰变而得到的。 由于在地球的各个端元中氦同位素之间的比值( He/ He)具有不同的特征值,彼此间 He/ He比值相差较大,所以氦的同位素比值可以成为判断流体来源较直观的地球化学证据。研究表明氦同位素比值在各个地质端元中相对稳定, 大气 中的 He/ He比值为1.4x10 , 地幔 中的 He/ He比值为n×10 , 地壳 中的 He/ He比值n×10 。 氦同位素
质量数
半衰期
He
3
稳定
He
4
稳定
He
5
602ys±22
He
6
806.92ms±0.24
He
7
2.51zs±0.07
He
8
119.5 ms±1.5
He
9
2.5 zs±2.3
He
10
260 ys±40
理化性质
物理性质 氦气(He)为元素周期表0族元素中的 稀有气体 ,原子序数为2,原子量4.00260,原子半径为140pm。在自然界中稳定存在的同位素为 He和 He。氦气为无色气体,是所有气体中最难液化的气体,其临界温度-267.9℃,临界压力约0.225MPa。氦气的密度为0.0001785g/cm ,熔点为-272.2℃(0.95K),沸点为-268.93℃(4.22K),沸点时的蒸发热为1kJ/kg,熔点时的溶解热热为5.72kJ/kg、15℃ 定压比热容 为1.25kJ/kg·℃。 液态氦在温度下降 超流体 ,能没有粘滞力地流动,热导率变得非常高,约为 铜 的800倍;其比热容、表面张力和压缩性都变得反常。因此在元素单质中,氦不仅是温度最低的流体,也基本不参与其他元素的化学反应。 氦具有异常的穿透力,能迅速地穿透某些有机聚合物、 陶瓷 、 石英 玻璃和 硼 硅 玻璃这些材料制的薄板。氦穿透 磷 硅玻璃漫射比穿过软玻璃快99倍。氦能穿过多种金属,但不能穿透 铁 和 铂 族金属。从天然气回收氦的方法之一就是根据选择
化学性质 氦属于最轻的惰性元素。在高压下,氦能与其他物质形成衍生物,如富勒烯;在极度的压力之下,氦可以与其他元素形成化合物,如氦钠化合物(Na 2 He)。
结构 氦原子核外只有一个轨道,并且被两个电子完全占据,没有额外的电子可以参与成键。
氦原子 的光谱比较复杂,但有着与碱金属原子类似的光谱线系,其光谱都可以归类到S、P、D等光谱线系。对光谱进行分析,发现每一个线系都有两套,就是有两套S线系、两套P线系、两套D线系等,其中的一套是单重的,而另一套是三重的。 氦有两套不同的能级。一套是单层的,另一套是三层的。正是由于这个原因,起初认为有两种氦:正氦和仲氦。正氦具有三重态能级,而仲氦具有单重态能级。在这两套能级内部的跃迁产生了两套相互独立的光谱。而且,这两套能级之间没有辐射跃迁。
除了能量最低的、比较稳定的基态和能量较高的、不稳定的激发态之外, 氦原子 中存在几个亚稳态,所谓亚稳态是指这样一些激发态,原子可以在这样的状态存在较长的时间,不容易很快退激发而跃迁到基态。氦原子的2 S 0 、2 S 1 等都是亚稳态,实验测得2 S 0 的寿命为19.5ms。
氦原子的基态1 S 0 与第一激发态2 S 1 之间的能量差很大,达到了19.77eV;电离电势也是所有元素中最大的,达到了25.48eV。
单重态中最低的能级是基态1 S 0 ,主量子数n=1;而三重态中,没有主量子数n=1的能级,最低能级2 S 1 的主量子数n=2。
属于三重漫线系的D 3 线,所对应的辐射跃迁为:
587.5963nm 3 D 1 →2 P 0 相对强度1
587.5643 nm 3 D 1,2 →2 P 1 相对强度3
587.5601nm 3 D 1,2,3 →2 P 2 相对强度5
实际上,3 D 1,2,3 态中三个能级的间隔很小,实验上不容易测出,上述跃迁的结果是依据光谱线的强度合跃迁的选择定则进行分析而得到的。
制备方法
天然气分离法: 天然气是最重要的氦资源,工业上生产的氦气基本上是从天然气中提取的,主要以含有氦的天然气为原料,反复进行液化分馏,然后利用 活性炭 进行吸附提纯,最后得到纯氦。其提氦技术一般需经过三个工艺步骤: ①含氦天然气的预净化。
②粗氦的制取。
③氦的精制。
合成氨法 以含氦的天然气为原料的合成 氨 装置中,合成循环气中逐步得到浓缩,在其弛放气中氦的含量是天然气中十倍左右,其提氦包括三个步骤: ①弛放气净化:主要是指脱除其所含的氨和水分。
②粗氦的提取:主要是用化学燃烧法、冻结法、甲烷洗涤吸收法和变压吸附法等脱除大部分所含的 氢 、 氮 、 氩 和 甲烷 等杂质,获得浓度50%以上的粗氦气体。 ③粗氦的精制:在工业上一般采用直接加氧燃烧法、纯氦稀释后加氧催化法除氢和低温吸附法除氢等方法获得90%以上氦气;再通过加压、冷却至77K以下脱除其中大部分杂质气体,然后在低温下用活性炭吸附脱除微量 氖 等杂质,获得99.99%以上的纯氦。
空气法 由于空气中约含有5.24×10 的氦气,可以通过大型深冷空分装置分离 氧 、氮和氩等后得到副产物纯氦。主要包括以下三个步骤: ①粗氖氦混合气的提取。
②纯氖氦混合气的制备。
③氖氦分离制备纯氦。
其中,氖氦分离是以液氖为冷源、2.5MPa压力和接近氖沸点的温度下,使氖氦混合气中大部分氖冷凝下来,然后在低于77K温度下,用活性炭去除残余的氖而获得纯氦。
铀矿石法 将含氦的铀矿石经过焙烧,分离出气体,再经过化学方法,除去水蒸气、 氢气 和 二氧化碳 等杂质提纯出氦。
应用领域
氦气
用作提升气 氦气的相对密度较空气小,在标准状态下1m 氦气的浮力为1.1kg,是氢气浮力的93%,氦又是惰性气体,因此是比氢气更为可靠的提升气,用于充气球和飞艇。
合成呼吸气 由于氦在血液和细胞组织中溶解度很小, 氧气 和氦气可以以1:4的比例混合成呼吸气,代替空气供深水潜水员呼吸用,还可以缩短潜水后减压时间。氦气渗透性很强,可以较快的渗透肺部。
压送和吹扫气 由于氦气的化学惰性和沸点低,在航天发射中用作燃烧系统吹扫气和各种燃料及 氧化剂 (如 液氢 、液氧)等压送。还可以给火箭助推器和宇宙飞船
焊接和保护气 与通常 氩 弧焊相比较,氦弧或氦-氩弧焊具有熔深大、速度快、焊缝中气孔少、热影响区过热现象轻、焊接部位低温塑性好等优点,已广泛用于 不锈钢 、铜、 镁 、 锆 、 钛 等金属或合金的焊接。氦气还可用作半导体、 光导纤维 等生产过程的保护气。
传热介质 由于氦不与 原子反应堆 的燃料和其他物质起化学反应,故氦气可用作原子反应堆冷却和热交换的传热介质。
光学仪器填充气 由于氦气的性质与理想气体十分接近,折射率又小,因此可用作光学仪器的填充气,使光学仪器获得很高灵敏度。
人造空气 将氦气和氧气按一定比例混合,便制成了特殊的空气——“人造空气”,并把这种空气装入钢瓶中,可以供潜水员潜入深海作业呼吸时使用,以避免“潜水病”。其次,“人造空气”使用氦气代替了 氮气 ,其密度大幅度减小,仅有普通空气密度的1/3,因此呼吸“人造空气”比呼吸普通空气要轻松得多,可以减轻潜水员的呼吸困难。
气体激光器 在医疗 帮助 氦氖激光器 在工农业生产、科研和教学等方面的应用也很广泛,尤其在流体的流速流量测量、精密计量、全息照相和准直导向等方面表现着主要作用。
泄露检测 氦气可以用于泄露检测,它被用作示踪气体来检测高真空设备和高压容器中的是否有泄漏。采用氦气为示踪气体的氦质频仪,借助质谱的分析方法,通过测定真空系统中氦气压强的变化来检查封装结构的细微漏孔。测试时首先向封装焊好的器件内压入氦气,然后在真空状态下抽出氦气,测定所抽出氦气的量来判断气密性。
液氦
超导冷却 液氦在超导冷却方面广泛应用于 核磁共振 设备、 超导量子干涉器 、 粒子加速器 、 磁悬浮列车 、电能的存储等,其中的最大消费群体是医院的核磁共振设备。缺乏氦气最严重的后果,是严重阻碍低温技术的应用,其中受到最大影响的就是低温超导技术。现在已知所有的超导材料都要在-130℃以下的低温中才能表现出超导特性,其中应用最广泛的几种(如Nb 3 Sn)更是需要比液氢的沸点还低的转变温度,这时候只有液氦能比较简便地实现这样的极低温。医院的核磁共振成像仪的核心大都是超导磁体,只有在液氦的低温下才能稳定运行,产生稳定的磁场,保证高分辨率的成像。
超低温冷却 液氦在超低温冷却方面广泛应用于核反应堆的冷却介质和清洗剂,第一代气冷裂变反应堆利用仅400℃左右的冷媒温度,采用价廉的二氧化碳作为冷媒气体。为了改善热效率,第二代反应堆设计采用高达790℃的气体冷媒温度。在此温度下,只有氦( He)具有必需的化学稳定性、惰性、高传热速率、低动力学压力损失和低中子有效截面,因此,只能用氦作为冷媒气体。
同位素 He可以作为非常理想的 聚变反应 材料。以D- He为燃料的聚变反应堆可以产生洁净和安全的聚变能,该反应的过程为:
安全事宜
安全标识 GHS分类
GHS
危险说明
危险等级
H280
含有加压气体;加热可能会爆炸
压力下的气体
H281
含有冷冻气体;可能导致低温烧伤或损伤
压力下的气体
健康危害 氦本身无毒的,但它可以通过置换空气中的氧气而造成窒息危险。吸入纯氦气易出现疲倦无力、昏迷、恶心、烦躁不安、呕吐、抽搐,以致死亡,所以在大量使用气态氦或液氦时,应在通风良好的地方进行,以避免形成缺氧空气。
氦气传播声音的速度差不多为空气的三倍,这会改变人的声带的共振态,于是使得吸入氦气的人说话的声音的频率变高,使得声音发生变化。
贮存与运输 氦可以用气态和液态方式贮存,气瓶应贮存于阴凉、通风的仓库内,温度不宜超过30℃,远离火种和热源,避免阳光直射,应与易燃易爆、可燃物分开存放。既可用管道输送也可用运输式罐装容器直接输送,其罐装容器为1L~30000L。液氦在工业上使用液氦运输贮槽或固定贮罐来运输和长期贮存,其容积一般100L~500L。